













Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
1- Revisar o pulmão (anatomia, fisiologia e vascularização) (principais características anatômicas e fisiológicas) 2- Compreender a fisiopatologia, fatores de risco e manifestações clínicas da tromboembolia pulmonar 3- Citar os exames de diagnóstico da tromboembolia.
Tipologia: Resumos
1 / 20

Esta página não é visível na pré-visualização
Não perca as partes importantes!













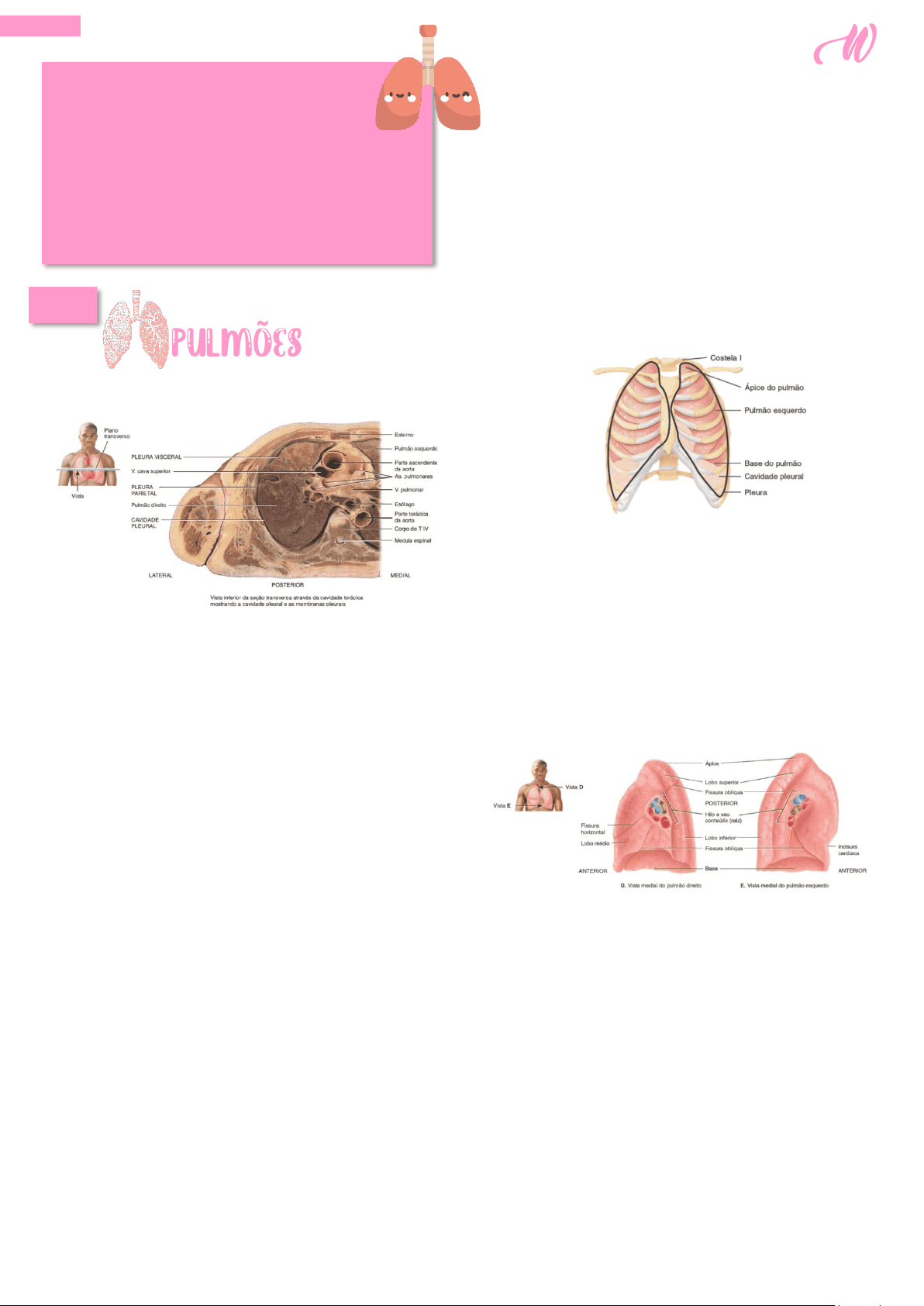
Os pulmões são órgãos cônicos pareados na cavidade torácica. Eles são separados um do outro pelo coração e por outras estruturas do mediastino, que dividem a cavidade torácica em duas câmaras anatomicamente distintas. Como resultado, se um traumatismo provocar o colapso de um pulmão, o outro pode permanecer expandido. Cada pulmão é fechado e protegido por uma túnica serosa de camada dupla chamada pleura. A camada superficial, chamada de pleura parietal , reveste a parede da cavidade torácica; a camada profunda, a pleura visceral , recobre os pulmões propriamente ditos. Entre a pleura visceral e a pleura parietal há um pequeno espaço, a cavidade pleural, que contém um pequeno volume de líquido lubrificante que é secretado pelas membranas. Este líquido pleural reduz o atrito entre as membranas, o que lhes possibilita deslizar facilmente uma sobre a outra durante a respiração. O líquido pleural também faz com que as duas membranas adiram uma à outra, assim como uma película de água faz com que duas lâminas microscópicas de vidro fiquem juntas, um fenômeno chamado de tensão superficial. Cavidades pleurais separadas circundam os pulmões esquerdo e direito. A inflamação da membrana pleural, chamada de pleurisia ou pleurite , pode em seus estágios iniciais causar dor decorrente do atrito entre as camadas parietal e visceral da pleura. Se a inflamação persistir, o líquido em excesso se acumula no espaço pleural, em uma condição conhecida como derrame pleural. Os pulmões se estendem desde o diafragma até a região discretamente superior às clavículas e encontra-se contra as costelas anterior e posteriormente. A larga parte inferior do pulmão, a base, é côncava e se encaixa sobre a zona convexa do diafragma. A parte superior estreita do pulmão é o ápice. A superfície do pulmão apoiada sobre as costelas, a face costal, coincide com a curvatura arredondada das costelas. A face mediastinal (medial) de cada pulmão contém uma região, o hilo do pulmão, por meio da qual os brônquios, os vasos sanguíneos pulmonares, os vasos linfáticos e os nervos entram e saem. Estas estruturas são mantidas unidas pela pleura e tecido conjuntivo e constituem a raiz do pulmão. Medialmente, o pulmão esquerdo também contém uma concavidade, a incisura cardíaca, em que o vértice do coração se encontra. Em razão do espaço ocupado pelo coração, o pulmão esquerdo é aproximadamente 10% menor do que o pulmão direito. Embora o pulmão direito seja mais espesso e mais largo, é também um pouco mais curto do que o pulmão esquerdo, porque o diafragma é maior no lado direito, acomodando o fígado que se encontra inferiormente a ele.
1 - Revisar o pulmão (anatomia, fisiologia e vascularização) (principais características anatômicas e fisiológicas) 2 - Compreender a fisiopatologia, fatores de risco e manifestações clínicas da tromboembolia pulmonar 3 - Citar os exames de diagnóstico da tromboembolia pulmonar OBJ- 1
Os pulmões preenchem quase todo o tórax. O ápice dos pulmões encontra-se superiormente ao terço médio das clavículas, e esta é a única área em que ele pode ser palpado. As faces anterior, lateral e posterior dos pulmões se apoiam sobre as costelas. A base dos pulmões se estende da 6a cartilagem costal anteriormente ao processo espinhoso da vértebra T X posteriormente. A pleura se estende de aproximadamente 5 cm abaixo da base, da 6a cartilagem costal anteriormente à costela XII posteriormente. Assim, os pulmões não preenchem completamente a cavidade pleural nesta área. A remoção do excesso de líquido na cavidade pleural pode ser feita sem lesionar o tecido pulmonar por meio da inserção de uma agulha anteriormente através do 7o espaço intercostal, em um procedimento chamado de toracocentese. A agulha é passada ao longo da margem superior da costela inferior para evitar danos aos nervos intercostais e vasos sanguíneos. Inferiormente ao 7o espaço intercostal há o perigo de penetrar o diafragma.
Uma ou duas fissuras dividem cada pulmão em lobos. Ambos os pulmões têm uma fissura oblíqua , que se estende inferior e anteriormente; o pulmão direito tem também uma fissura, a fissura horizontal do pulmão direito. A fissura oblíqua no pulmão esquerdo separa o lobo superior do lobo inferior. No pulmão direito, a parte superior da fissura oblíqua separa o lobo superior do lobo inferior ; a parte inferior da fissura oblíqua separa o lobo inferior do lobo médio , que é limitado superiormente pela fissura horizontal. Cada lobo recebe seu próprio brônquio lobar. Assim, o brônquio principal direito dá origem a três brônquios lobares chamados brônquios lobares superior, médio e inferior ; o brônquio principal esquerdo dá origem aos brônquios lobares superior e inferior. No pulmão, os brônquios lobares dão origem aos brônquios segmentares , que são constantes tanto em origem quanto em distribuição (existem 10 brônquios segmentares em cada pulmão). O segmento de tecido pulmonar que cada brônquio segmentar supre é chamado segmento broncopulmonar. As doenças brônquicas e pulmonares (como os tumores ou abscessos) que estão localizados em um segmento broncopulmonar podem ser removidas cirurgicamente sem perturbar gravemente o tecido pulmonar circundante. Cada segmento broncopulmonar dos pulmões tem muitos pequenos compartimentos, chamados lóbulos ; cada lóbulo é envolvido por tecido conjuntivo elástico e contém um vaso linfático, uma arteríola, uma vênula e uma ramificação de um bronquíolo terminal. Os bronquíolos terminais subdividem-se em ramos microscópicos chamados bronquíolos respiratórios. Eles também têm alvéolos (descritos adiante) ramificando-se de suas paredes.
Estendendo-se do alvéolo ao plasma sanguíneo, a membrana respiratória é composta por quatro camadas:
Os pulmões são irrigados por dois conjuntos de artérias: as artérias pulmonares e os ramos bronquiais da parte torácica da aorta. O sangue venoso passa pelo tronco pulmonar, que se divide em uma artéria pulmonar esquerda que entra no pulmão esquerdo e uma artéria pulmonar direita que entra no pulmão direito. (As artérias pulmonares são as únicas artérias do corpo que transportam sangue desoxigenado.) O retorno do sangue oxigenado para o coração ocorre pelas quatro veias pulmonares , que drenam para o átrio esquerdo. Uma característica única dos vasos sanguíneos pulmonares é a sua constrição em resposta à hipoxia (baixo nível de O2) localizada. Em todos os outros tecidos do corpo, a hipoxia provoca a dilatação dos vasos sanguíneos para aumentar o fluxo sanguíneo. Nos pulmões, no entanto, a vasoconstrição em resposta à hipoxia desvia sangue pulmonar de áreas dos pulmões com pouca ventilação para regiões bem ventiladas para possibilitar trocas gasosas mais eficientes. Este fenômeno é conhecido como equilíbrio ventilação-perfusão , porque a perfusão (fluxo sanguíneo) para cada área dos pulmões corresponde à extensão da ventilação (fluxo de ar) para os alvéolos nessa área. Os ramos bronquiais da parte torácica da aorta levam sangue oxigenado aos pulmões. Este sangue perfunde principalmente as paredes musculares dos brônquios e bronquíolos. No entanto, existem conexões entre os ramos bronquiais e os ramos das artérias pulmonares; a maior parte do sangue retorna ao coração por meio das veias pulmonares. Um pouco de sangue drena para as veias bronquiais, ramos do sistema ázigo, e retorna ao coração por meio da veia cava superior.
Ao longo da discussão dos órgãos respiratórios, foram dados vários exemplos de estruturas ou secreções que ajudam a manter a perviedade do sistema de modo que as vias respiratórias permaneçam desobstruídas. Estas incluíram as estruturas ósseas e cartilagíneas do nariz, os músculos esqueléticos da faringe, as cartilagens da laringe, os anéis de cartilagem em formato de C da traqueia e brônquios, o músculo liso dos bronquíolos e o surfactante dos alvéolos. Infelizmente, há também condições que podem comprometer a perviedade. Estas incluem lesões por esmagamento de ossos e cartilagens, desvio de septo nasal, pólipos nasais, inflamação das túnicas mucosas, espasmos do músculo liso e deficiência de surfactante.
O processo de troca gasosa no corpo, chamado de respiração, tem três passos básicos:
A respiração externa nos pulmões converte o sangue venoso (discretamente depletado de O2) que vem do lado direito do coração em sangue oxigenado (saturado com O2) que retorna para o lado esquerdo do coração. Conforme o sangue flui pelos capilares pulmonares, capta O2 do ar alveolar e descarrega CO2 no ar alveolar. Embora este processo geralmente seja chamado de “troca” gasosa, cada gás se difunde independentemente da área em que sua pressão parcial é maior para a área em que sua pressão parcial é menor. Como mostra a Figura abaixo, o O2 se difunde do ar alveolar, onde sua pressão parcial é de 105 mmHg, para o sangue nos capilares pulmonares, onde a PO2(pressão parcial de oxigênio) é de apenas 40 mmHg em uma pessoa em repouso. Se você está se exercitando, a PO2 será ainda menor, porque as fibras musculares em contração estão usando mais O2. A difusão continua até que a PO2 do sangue capilar pulmonar aumenta para coincidir com a PO2 do ar alveolar, 105 mmHg. Como o sangue que sai dos capilares pulmonares próximos dos alvéolos se mistura com um pequeno volume de sangue que fluiu pelas partes condutoras do sistema respiratório, onde não podem ocorrer trocas gasosas, a PO2 do sangue nas veias pulmonares é discretamente menor do que a PO2 nos capilares pulmonares, de aproximadamente 100mmHg. Enquanto o O2 está se difundindo do ar alveolar para o sangue desoxigenado, o CO2 está se difundindo no sentido oposto. A PCO2 do sangue venoso é de 45 mmHg em uma pessoa em repouso, e a PCO2 do ar alveolar é de 40 mmHg. Em decorrência dessa diferença na PCO2, o dióxido de carbono se difunde do sangue oxigenado para os alvéolos até que a PCO2 do sangue diminua para 40 mmHg. A expiração mantém a PCO2 alveolar em 40 mmHg. O sangue oxigenado retorna para o lado esquerdo do coração pelas veias pulmonares; portanto, tem uma PCO2 de 40mmHg. Existem muitos capilares próximos dos alvéolos nos pulmões, e o sangue flui por estes capilares lentamente o suficiente para captar o máximo de O2. Durante o exercício vigoroso, quando o débito cardíaco aumenta, o sangue flui mais rapidamente pelas circulações sistêmica e pulmonar. Como resultado, o tempo de trânsito do sangue nos capilares pulmonares é mais curto. Ainda assim, a PO2 do sangue nas veias pulmonares normalmente alcança 100 mmHg. No entanto, em doenças que diminuem a taxa de difusão de gases, o sangue não é capaz de entrar em equilíbrio completo com o ar alveolar, especialmente durante o exercício. Quando isso acontece, a PO2 declina e a PCO aumenta no sangue arterial sistêmico.
O ventrículo esquerdo bombeia sangue oxigenado para a aorta e pelas artérias sistêmicas para os capilares sistêmicos. A troca de O2 e CO2 entre os capilares sistêmicos e as células teciduais é chamada de respiração interna ou trocas gasosas sistêmicas. Conforme o O2 deixa a corrente sanguínea, o sangue oxigenado é convertido em sangue venoso. Ao contrário da respiração externa, que ocorre somente nos pulmões, a respiração interna ocorre nos tecidos de todo o corpo. A PO2 do sangue bombeado para os capilares sistêmicos é maior (100 mmHg) do que a PO2 nas células teciduais (40 mmHg em repouso), porque as células usam constantemente O2 para produzir ATP. Em razão desta diferença de pressão, o oxigênio se difunde para fora dos capilares em direção às células teciduais e a PO2 do sangue cai para 40 mmHg no momento em que o sangue sai dos capilares sistêmicos. Enquanto o O2 se difunde dos capilares sistêmicos para as células teciduais, o CO2 se difunde no sentido contrário. Dado que as células teciduais estão constantemente produzindo CO2, a PCO2 das células (45mmHg em repouso) é maior do que a do sangue capilar sistêmico (40 mmHg). Como resultado, o CO2 se difunde das células teciduais pelo líquido intersticial para os capilares sistêmicos até que a PCO2 no sangue aumenta para 45 mmHg. O sangue desoxigenado então retorna para o coração e é bombeado para os pulmões para outro ciclo de respiração externa. Em uma pessoa em repouso, as células teciduais necessitam de em média apenas 25% do O2 disponível no sangue oxigenado; apesar do nome, o sangue desoxigenado mantém 75% de seu teor de O2. Durante o exercício, mais O2 se difunde do sangue para as células metabolicamente ativas, como as das fibras do músculo esquelético em contração. As células ativas usam mais O2 para a produção de ATP, fazendo com que o teor de O2 do sangue venoso caia abaixo de 75%. A taxa de trocas gasosas pulmonar e sistêmica depende de vários fatores.
Tromboêmbolos quase nunca se originam na circulação pulmonar, mas chegam através da circulação venosa. Mais de 95% dos tromboêmbolos pulmonares se originam de trombos nas veias profundas da extremidade inferior: as veias poplíteas, femorais e ilíacas. Trombose venosa abaixo das veias poplíteas, ou ocorrendo nas veias superficiais da perna, é clinicamente comum, mas não é um fator de risco para tromboembolismo pulmonar, porque trombos nessas localizações raramente migram para a circulação pulmonar sem antes se estender acima do joelho. Como menos de 20% dos trombos na panturrilha se estenderão para as veias poplíteas, trombos isolados na panturrilha podem ser observados com testes seriados para excluir extensão ao sistema profundo, e não precisam de anticoagulação, necessariamente. Tromboses venosas ocorrem ocasionalmente nas extremidades superiores ou no lado direito do coração; isso acontece mais comumente na presença de cateteres intravenosos ou fios de marca-passo cardíaco , e pode ter importância clínica crescente à medida que aumenta o uso prolongado de cateteres intravenosos. Portanto, os fatores de risco para tromboembolia pulmonar são os mesmos para o desenvolvimento de trombose venosa nas veias profundas das pernas (trombose venosa profunda). O patologista alemão Rudolf Virchow declarou esses fatores de risco em 1856: estase venosa, lesão da parede vascular e aumento da ativação do sistema de coagulação(trombofilias). Suas observações permanecem válidas até hoje. A estase sanguínea é um dos mais importantes itens da tríade, uma vez que a associação entre pacientes acamados, seja por cirurgia ou impossibilidade de movimentar-se, é conhecida e descrita desde o século XIX. O paciente em repouso fica com a musculatura relaxada, permitindo maior volume sanguíneo acumulado nos membros inferiores, além da própria dilatação da parede venosa. Esses itens, associados à redução do débito cardíaco no repouso e a não utilização dos mecanismos de retorno venoso da contração da panturrilha, causam queda da velocidade de fluxo local e consequente instalação da estase sanguínea local. Servitt, ao estudar o local de formação dos trombos em estudos realizados em necropsias, propôs a hipótese de que a diminuição de fluxo causaria alteração do fluxo laminar local nas veias, em especial nas válvulas venosas, criando turbilhonamento de sangue nesse local. Esse turbilhonamento local nos seios valvulares causaria acúmulo de hemácias e plaquetas que, em condições normais, seria “lavado" pelo fluxo venoso. A estase promovida pelo repouso prolongado é responsável pela ativação da agregação plaquetária e, consequentemente, pela ativação da cascata de coagulação nesse local. Esse mecanismo causaria uma rede de fibrina que, por sua vez, seria responsável pelo aprisionamento de hemácias nos seios das válvulas venosas e, por meio da agregação plaquetária local com liberação de ADP e tromboxano A2 , causaria progressão da coagulação local e do trombo na luz do vaso. A lesão endotelial é trombogênica pela própria ativação da cascata da coagulação. O endotélio vascular não é somente uma camada celular em contato com a luz, mas também um tecido biológico ativo que, em condições normais, impede a formação de trombos, mantendo o sangue em sua forma líquida por meio da produção de óxido nítrico (NO), prostaglandina I2 (prostaciclina), ADP- defosfatase.
Essas substâncias impedem a adesão plaquetária local ao inativar os receptores da plaqueta (NO e prostaciclina) e causar quebra do ADP (ADP- defosfatase). Além disso, o endotélio impede a adesão plaquetária, uma vez que constitui uma barreira entre o sangue e a matriz extracelular. O endotélio vascular em condições normais não apenas mantém as plaquetas inativas, impedindo a adesão e a agregação, mas também evita a coagulação local ao impedir a presença de fatores pró- coagulantes ativados. O complexo sulfato de heparano-antitrombina III , que inativa moléculas de trombina, fator X ativado (Xa) e fator IX ativado (IXa). A trombomodulina forma um complexo com a trombina após modular sua função e ativa a proteína C, que, por sua vez, inativa o fator V ativado (Va) e o fator VIII ativado (VIIIa). O ativador do plasminogênio tecidual (t-PA) converte o plasminogênio em plasmina, uma enzima fibrinolítica responsável pela degradação da fibrina. Diversos fatores, como traumas (iatrogênicos ou não), radiação, infecção, drogas, lesões térmicas, citocinas e anticorpos, além de outros, podem ser responsáveis pela lesão do endotélio vascular saudável, causando exposição da matriz extracelular, produção de tromboxano A2 e ADP, adesão e agregação plaquetária, com formação de trombina (que estimula a agregação) e, por sua vez, a ativação da cascata de coagulação, com formação de fibrina por meio da ativação dos fatores VII, IX e X. O próprio trauma cirúrgico e a reação inflamatória com leucocitose podem ser suficientes para lesão do endotélio e pela consequente formação de trombos em pacientes no pós-operatórios. A hipercoagulabilidade sanguínea , ou trombofilia , pode ser de origem genética ou adquirida. Na origem genética pode-se encontrar uma deficiência de fatores que impedem a coagulação, como a antitrombina, a proteína C e a proteína S. Pode-se também encontrar resistência à proteína C ativada causada por mutação no fator V , encontrada em 20 a 50% dos pacientes com TVP, sendo a trombofilia mais comum nos pacientes com TEV. Ela também é conhecida como fator V de Leiden , fator V mutante ou, também, como FVR Q ou FV:Q, evidenciando a mutação que leva à substituição de arginina (R) por glutamina (Q) em uma transição no nucleotídeo, causando uma alteração na função no fator V da coagulação que acarreta resistência à proteína C. Constituem também causas genéticas, alterações no gene da protrombina , que é encontrada em 6 a 18% dos pacientes com TVP, e a hiper-homocisteinemia, que encontra sua origem na mutação do gene da metiltetra-hi-drofolatoredutase (MTHFR). Na origem adquirida, temos fatores teoricamente temporários como a gravidez , uso de anticoncepcionais orais (em especial os combinados com estrogênio e progestágenos), cirurgias , tabagismo , obesidade e infecções. Temos, também, doenças adquiridas, como a síndrome do anticorpo antifosfolípide (SAAF) , neoplasias, vasculites, poliglobulias e outras. A SAAF é uma doença autoimune na qual anticorpos se ligam a proteínas plasmáticas, em fosfolípides de membrana. As proteínas que são reconhecidas como antígeno são: a protrombina (fator II) e a beta- 2 - glicoproteína I (beta- 2 - GPI), além da proteína C, proteína S , fator X, fator XI, entre outras. Essa síndrome causa trombose venosa e arterial (na maioria das vezes venosa) e tem uma manifestação clínica variada por conta da quantidade de proteínas com potencial antigênico. Nos membros inferiores, até 50% dos trombos localizados na musculatura da panturrilha apresentam resolução espontânea e aproximadamente 15% evoluem até acometer a veia femoral. Até um terço das TVP de panturrilha não tratadas acabam por acometer veias proximais. Após 1 mês, 20% das TVP proximais não tratadas vão regredir, enquanto 25% vão se propagar. É importante saber que, ainda que os trombos de panturrilha sejam causas raras de TEP , pode ocorrer na incidência de 29 a 50%, caso a trombose inicial não seja tratada adequadamente.
Historicamente, pensava-se que a deltaP02A-a fosse um indicador mais sensível de EP porque compensa a presença de hipocapnia e a quantidade inspirada de Fi02. Entretanto, o estudo Prospective Investigation ofPulmonary Embolism Diagnosis II (PIOPED II) (Investigação Prospectiva do Diagnóstico de Embolia Pulmonar II) questiona esse pensamento. Uma delta P02A-a menor que 20, que é normal ou quase normal a depender da idade do paciente, foi encontrada em um terço dos pacientes com EP aguda identificada por TC. Nenhum mecanismo isolado explica a hipoxemia na EP aguda. Pelo menos cinco mecanismos têm sido sugeridos:
A hipertensão pulmonar é definida como uma pressão arterial pulmonar média maior ou igual a 25 mmHg em repouso. Com base no mecanismo subjacente, a Organização Mundial da Saúde classificou a hipertensão pulmonar em cinco grupos. Eles são: (1) hipertensão arterial pulmonar, uma grande coleção de disfunções que impactam primariamente artérias musculares pulmonares pequenas; (2) hipertensão pulmonar secundária à insuficiência cardíaca esquerda; (3) hipertensão pulmonar originada de doença do parênquima pulmonar ou hipoxemia; (4) hipertensão pulmonar tromboembólica crônica; e (5) hipertensão pulmonar de base multifatorial. Como podemos perceber pela classificação citada, a hipertensão pulmonar tem diversas causas. Está frequentemente associada a condições
cardiopulmonares estruturais que aumentam o fluxo sanguíneo pulmonar, à resistência vascular pulmonar ou à resistência ao fluxo sanguíneo no lado esquerdo do coração dentre varias causas vale destacar nesse APG:
- Tromboembolismo recorrente (grupo 4). A embolia pulmonar recorrente pode causar hipertensão pulmonar pela redução da área funcional do leito vascular pulmonar, que, por sua vez, leva a um aumento na resistência vascular pulmonar.
Quase todos os trombos arteriais pulmonares grandes têm origem embólica, geralmente provenientes das veias profundas dos membros inferiores. A grande maioria dos êmbolos (60% a 80%) é clinicamente silenciosa, uma minoria (5%) causa cor pulmonale agudo, choque ou morte (geralmente de grandes “êmbolos a cavaleiro”), e o restante causa infartos pulmonares. O risco de recorrência é alto.
A presença de fatores de risco para o tromboembolismo venoso é a condição inicial para o estabelecimento de elevada suspeita clínica e, também, para realização de adequada profilaxia. As situações em que prevaleçam um ou mais componentes da tríade de Virchow4 (estase venosa, lesão endotelial e estado de hipercoagulabilidade) são as propícias ao desenvolvimento da trombose. Os principais fatores de risco para o tromboembolismo venoso são: trauma não cirúrgico e cirúrgico; idade maior que 40 anos; tromboembolismo venoso prévio; imobilização; doença maligna, insuficiência cardíaca; infarto do miocárdio; paralisia de membros inferiores; obesidade; veias varicosas; estrogênio; parto; doença pulmonar obstrutiva crônica.
A TVP é mais comum após os 40 anos de idade, havendo aumento exponencial com a idade, assim, entre os 25 e 35 anos, a incidência de TEV é de cerca de 30 casos/100.000 pessoas/ano e, dos 70 a 79 anos, essa incidência chega a 300 a 500 casos/100.000 por ano. Da mesma maneira, a frequência de EP, tanto no diagnóstico in vivo como em necropsias, aumenta com a idade. Uma hipótese levantada para explicar esse fato foi a de que a diminuição da resistência da parede venosa, com a idade, poderia propiciar a dilatação da veia, e, consequentemente, a diminuição da velocidade do fluxo sanguíneo, facilitando o desenvolvimento da trombose. Além disso, foi encontrada menor atividade fibrinolítica nas veias da perna em indivíduos de mais de 65 anos, podendo ser um fator a mais para esse desenvolvimento. Embora rara, a TVP e a EP existem em crianças e adolescentes, e a possibilidade de seu diagnóstico deve ser lembrada sempre que surgirem sintomas da doença, devendo-se realizar confirmação diagnóstica e tratamento em caso positivo.
A obesidade parece ser um fator de risco para o desenvolvimento de TVP em pacientes acamados, possivelmente devido à dificuldade de mobilização do paciente e, talvez, a uma diminuição da atividade fibrinológica que ocorreria em obesos. Lowe demonstraram, em estudo prospectivo multicêntrico, ser a obesidade um fator de risco independente para o desenvolvimento de TVP em pacientes submetidos à prótese de quadril. Os trabalhos de Tsai e de Abdullah mostraram uma razão de risco de TVP acima de 2 em pacientes com índice de massa corpórea maior que 30. Nem todos os autores, entretanto, encontraram relação entre obesidade e TVP, principalmente em pacientes de ambulatório.
Existem algumas indicações já antigas de que, quanto maior a operação a que foi submetido um paciente, maior o risco de TVP. Kakkar entretanto, só encontraram significância quanto ao porte da operação em pacientes idosos.
O tipo de anestesia usado durante o ato cirúrgico também parece influir no risco de desenvolvimento de TVP, sendo está mais frequente em pacientes
Posteriormente, estudos retrospectivos comparando grupos de pacientes com TVP com grupos-controle mostraram incidência maior de TVP nas mulheres que tomaram anticoncepcionais. Esses estudos, além de retrospectivos, tinham como ponto negativo o fato de o diagnóstico de TVP ter sido feito clinicamente. Estudos prospectivos com grande número de pacientes mostraram resultados conflitantes. Metanálises incluindo estudos controlados ou de acompanhamento e estudos populacionais recentes confirmaram o papel dos ACO no desenvolvimento da TVP e da EP , aumentando de 3 a 6 vezes o risco de TEV. Aumento de incidência de TVP e EP foi mostrado tanto em mulheres tomando estrógeno para supressão de lactação quanto em homens tratados com estrógeno com o intuito de diminuir a incidência de doenças cardiovasculares de origem aterosclerótica. Várias alterações que poderiam contribuir para o desenvolvimento do TEV foram descritas, quer em pacientes, quer experimentalmente, com o uso de estrogênios: aumento dos níveis sanguíneos de fatores de coagulação como II, VII, IX, X, redução dos níveis de antitrombina, resistência secundária à proteína C , depleção do ativador do plasminogênio das paredes vasculares e aumento de complexos solúveis de momômeros de fibrina no plasma. Além disso, alterações na viscosidade sanguínea e de parede vascular foram descritas com o uso de estrógeno. Parece, entretanto, que seu desenvolvimento está mais ligado ao uso de doses altas de estrógenos. Vários trabalhos sugeriram que doses baixas desse hormônio, como as usadas atualmente em vários ACO, possam acarretar menor risco a suas usuárias. Ao longo dos anos, foram empregadas 3 gerações de ACO : a 1a, em que se administravam doses de estrógeno maiores que 50 μg, hoje consideradas mais trombogênicas ; uma 2a com doses de 30 μg, associadas a uma progestina, o levonorgestrel, aparentemente menos trombogênica; e, finalmente, uma 3a, em que também se usaram doses de 30 mg de estrógeno porém com progestinas diferentes das de 2a geração (desogestrel, gestodene e norgestimato), com as quais se esperava diminuir efeitos colaterais metabólicos androgênicos, sem aumento do risco trombótico. Verificou-se, entretanto, posteriormente, que esses ACO de 3a geração apresentavam um risco cerca de 3 vezes maior de TEV que os de 2a geração, fato similar ao ocorrido com a drospirenona. Os anticoncepcionais ministrados por via transdérmica e por dispositivo intrauterino e composto apenas por progesterona parecem ser menos trombogênicos e poderiam ser usados em mulheres com maior risco de TEV. Mais recentemente tem sido demonstrado o importante papel da interação de fatores na TVP, com o aumento da incidência de TVP em mulheres que tomam ACO e são portadoras de trombofilia. Encontraram também que, nas que não tomavam ACO, mas eram portadoras de fator V Leiden, o risco de TVP era 8 vezes maior: quando a mulher era portadora do fator V Leiden e tomava ACO, esse risco aumentava para 30 vezes, mostrando não só um efeito aditivo nessa associação, mas um efeito potencializador. Um problema é o aconselhamento dessas mulheres, pois na gravidez e no puerpério o risco de trombose venosa é maior que com o uso de contraceptivo. A indicação de anticoncepcionais somente à base de progesterona parece ser, no momento, a melhor indicação.
Outro uso de estrógenos que tem se tornado rotina em mulheres pós-menopausa ou pós-ooforectomia é o tratamento de reposição hormonal. Os estudos iniciais não mostraram relação entre esse tipo de tratamento e a TVP, porém trabalhos mais recentes, incluindo 2 grandes estudos prospectivos com um total de 18.500 mulheres, mostraram a existência de um aumento, tanto de TVP, como de EP em mulheres usando essa terapia. Nesse caso, os hormônios usados por via transdérmica também parecem oferecer menor risco, assim como a tibolona.
A hipótese de que pacientes do grupo sanguíneo O eram menos suscetíveis à TVP foi levantada a partir de estudo retrospectivo de pacientes em tratamento anticoagulante para essa doença e depois confirmada por estudos multicêntricos, também retrospectivos,
comparando mulheres jovens com TVP com grupo-controle. Posteriormente, vários outros trabalhos, também em mulheres jovens, confirmaram esses achados e sugeriram serem as do grupo sanguíneo A mais suscetíveis à TVP. Não se tem uma explicação para esse fato, entretanto, pode haver alguma relação com aumento de fator VIII, que também parece ser um fator de risco ou marcador de TVP. Em pacientes de mais de 40 anos de idade submetidos à cirurgia geral e estudados com TFM, tal diferença de suscetibilidade não foi verificada, sendo de 28% a incidência encontrada em pacientes do grupo A e de 30% em paciente do grupo O. Esses dados mostram que é possível haver influência dos grupos sanguíneos na propensão ao desenvolvimento de TVP ; tal influência, porém, talvez se restrinja a determinados grupos etários.
Embora inicialmente tenha sido levantada a hipótese de diferença na incidência de TVP e de EP entre diferentes etnias, com base em dados epidemiológicos de incidência em diferentes países, esses dados têm sido muito contraditórios. Estudos recentes têm mostrado menor incidência de algumas alterações genéticas, como fator V Leiden e protrombina G20210A em populações negras de origem africana, ameríndios e asiáticos. Em negros do Caribe foi encontrada incidência menor de TVP do que em populações brancas de outros países. No entanto, dados mais recentes contestam esses achados, indicando haver, pelo menos em populações afrodescendentes da América do Norte, uma frequência de TEV 30 a 60% maior que em americanos de origem europeia e 3 vezes maior que em americanos de origem asiática.
Embora a TVP seja um evento relativamente raro em pacientes em idade fértil, a gravidez aumenta o risco dessa doença em cinco vezes, com incidência de 1 a 2 casos de trombose a cada 1.000 gestações. Alterações anatômicas e hormonais contribuem para a estase venosa por meio da compressão pelo aumento do volume abdominal e aumento de distensibilidade venosa pela progesterona. Existe também um aumento dos fatores I, li, VII, VIII, X e XII, redução da proteína S, inibição do ativador do plasminogênio 1 e 2 e ele vação na geração de trombina, levando a um estado de hipercoagulabilidade.
A tríade clássica de um início súbito de dispneia, dor torácica pleural e hemoptise acontece em uma minoria dos casos. Em um grande estudo de pacientes com EP, dispneia estava presente em 73% dos casos, e dor torácica pleural estava presente em 44% das vezes. É provável que a dispneia resulte de broncoconstrição reflexa, bem como de pressão da artéria pulmonar aumentada, perda de complacência pulmonar e estimulação de fibras C. Em pacientes com êmbolos grandes, a sobrecarga aguda do coração direito pode contribuir para dispneia. Dor torácica pleural é mais comum que infarto pulmonar; um grupo tem sugerido que a dor é causada por áreas de hemorragia pulmonar. Hemoptise é observada com infarto pulmonar, mas também pode resultar da transmissão de pressões arteriais sistêmicas à microvasculatura por meio de anastomoses broncopulmonares, com ruptura subsequente de capilares. Isso pode refletir edema pulmonar hemorrágico por depleção de surfactante ou lesão de capilares associada a neutrófilos. Síncope pode indicar uma embolia maciça. O achado de exame físico mais convincente não está no tórax, e sim na perna: uma panturrilha inchada, dolorosa, quente e avermelhada que fornece evidência para trombose venosa profunda. A ausência de tal evidência não exclui o diagnóstico, porque o exame clínico é pouco sensível, e a ausência de sinais pode indicar que o trombo inteiro foi embolizado. Achados de ausculta do tórax são comuns, mas inespecíficos.
A elevação da troponina I está associada à disfunção do VD e à presença de múltiplos defeitos segmentares na cintilografia pulmonar53.
O exame é considerado positivo quando da visibilização do trombo ou redução da compressibilidade das veias profundas dos membros inferiores, com sensibilidade e especificidade superiores a 90% para a trombose venosa proximal. O diagnóstico da TVP pode evitar a realização de exames para identificar o trombo na circulação pulmonar, já que esta possui abordagem terapêutica semelhante à EP.
Uma cintilografia de perfusão é obtida pela injeção de albumina radiomarcada microagregada com um tamanho de partícula de 50 a 100 μm no sistema venoso, permitindo que as partículas embolizem o leito capilar pulmonar (diâmetro aproximado de 10 μm). A substância é marcada com um isótopo de tecnécio emissor de gama (pertecnetato Tc-99m) que possibilita o mapeamento da distribuição do fluxo sanguíneo pulmonar. Uma cintilografia de ventilação é realizada fazendo o paciente respirar xenônio (Xe-133) ou um aerossol radiativo, e realizando cintilografias sequenciais durante inalação e exalação. Uma cintilografia de perfusão normal exclui tromboembolismo pulmonar clinicamente significativo. Um defeito de perfusão segmentar ou maior em uma área radiograficamente normal que mostra ventilação normal é diagnóstico. Isso é chamado de defeito "desequilibrado" (mismatch) e é altamente específico (97%) para tromboembolismo pulmonar. Contudo, somente uma minoria das cintilografias de ventilação/perfusão revela claramente achados diagnósticos. O estudo PIOPED demonstrou que cintilografias de ventilação/perfusão não diagnósticas podem estratificar o risco de tromboembolismo pulmonar de um paciente. Além disso, dentro das categorias de estudos de alta, média e baixa probabilidade, a avaliação do médico antes do exame da probabilidade de tromboembolismo pulmonar pode estratificar ainda mais os pacientes.
A TC helicoidal vem sendo amplamente utilizada na investigação de pacientes com suspeita clínica de EP. A boa acurácia, o custo relativamente baixo - se comparado à arteriografia convencional, a possibilidade de investigação de outros diagnósticos diferenciais está entre as vantagens da TC, frente a outras estratégias. Revisão sistemática de nove estudos demonstrou a sensibilidade variando de 53 a 100% e a especificidade entre 81 e 100%, sendo o método mais sensível para identificar trombos nos ramos principais, lobares e segmentares. A possibilidade de avaliação da trombose venosa profunda através da venografia constitui um outro atrativo para a utilização da TC, que tem a possibilidade de avaliar vasos pélvicos e abdominais onde o duplex- scan apresenta limitações.
A angiografia pulmonar é um procedimento seguro, mas invasivo, com dados de morbidade e mortalidade bem definidos. A AGP é considerada o método padrão para o diagnóstico da EP com a visibilização da circulação pulmonar, após a injeção de contraste iodado. O uso de cateteres mais finos e flexíveis e a melhor definição da imagem com a incorporação da técnica de subtração digital têm melhorado a acurácia do método. As principais complicações do método são a anafilaxia e a nefrotoxicidade induzida pelo contraste, que pode ser minimizada com uma adequada hidratação venosa. Complicações menores ocorrem em aproximadamente 5% dos pacientes. A maioria delas consiste em reações alérgicas a contraste ou lesão renal transitória, ou está relacionada com a inserção percutânea de cateter;
perfuração cardíaca e arritmias foram relatadas, mas são raras. Dentre os pacientes do PIOPED I que fizeram angiografia, 5 óbitos (0,7%) foram relacionados diretamente com o procedimento. Há concordância geral de que a angiografia está indicada quando o diagnóstico é incerto, mas há uma alta probabilidade clínica pré-exame de EP, ou quando o diagnóstico de EP deve ser estabelecido com certeza, como quando anticoagulação está contraindicada ou quando se contempla a colocação de um filtro na veia cava inferior. Um defeito de enchimento intralúmen em mais de uma incidência estabelece um diagnóstico definitivo. Achados secundários altamente sugestivos de EP incluem uma interrupção arterial abrupta, assimetria de fluxo sanguíneo (especialmente oligoemia segmentar) ou uma fase arterial prolongada com enchimento lento.
A possibilidade da visibilização das artérias pulmonares, sem a necessidade da utilização de contraste iodado e sem exposição à radiação, é a principal vantagem da RM. Em um estudo comparativo com a tomografia helicoidal, avaliado por cinco observadores, a ressonância magnética mostrou sensibilidade de 46% e especificidade de 90%.