










Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
O documento desenvolve sobre a materia e sua composicao,
Tipologia: Manuais, Projetos, Pesquisas
1 / 15

Esta página não é visível na pré-visualização
Não perca as partes importantes!










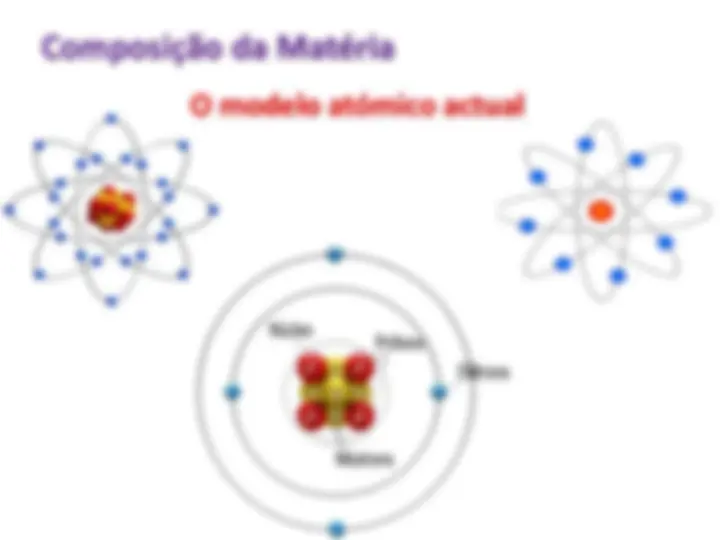
A matéria consiste de átomos e moléculas.
0 Electrosfera Electrão (e) 9,1095× 10 –**^31 kg 1/1836 – 1,6022× 10 –^19 C – 1
O modelo atómico actual
Ião é um átomo electricamente carregado. Um Ião pode ter carga positiva ou negativa:
- Catião – átomo que perdeu electrões e que, portanto, possui carga positiva. Ex: Na + = átomo de sódio que perdeu 1 electrão; - Anião – átomo que ganhou electrões, e que, portanto, possui carga negativa. Ex: O 2 – = átomo de oxigénio que ganhou 2 electrões.
Número de massa (A) é a soma dos números de protões e neutrões de um átomo, partículas chamadas de nucleões, pois são integrantes do núcleo. A = Z + N Ex: Um átomo de potássio ( K ) que possui 19 protões ( Z ) e 20 neutrões ( N ), tem número de massa ( A ) 39. A= Z + N A= 19 + 20 A= 39
Massa atómica de um átomo é a massa do átomo medida em unidades de massa atômica (u.m.a) – A massa atómica indica quantas vezes o átomo considerado é mais pesado que 1 / 12 do isótopo 12 6
A massa atómica é dada por um valor muito próximo do número de massa, mas as duas grandezas são diferentes. Exemplo: o átomo de 35 17 Cl possui número de massa igual a 35 , mas sua massa atómica é 34 , 969 u.m.a
Isótopos são átomos do mesmo elemento químico, portanto possuem o mesmo número atómico ( Z ), mas possuem diferentes números de neutrões. Exemplo: os isótopos do hidrogénio são o prótio ( 1 1
o deutério ( 2 1 H) e o trítio ( 3 1
Isóbaros são átomos de elementos químicos diferentes que possuem o mesmo número de massa ( A ). Ex: 14 6
14 7
e
1. Dado o átomo 11 Na 23 pede-se: a) O n° atómico b) O n° de massa c) O n° de protões d) O n° de electrões e) O n° de neutrões 2. Dados os elementos genéricos 15 I 30 , 18 II 33 , 13 III 30 , 18 IV 29 , 14 V 31 , responda? a) Quais são isótopos? b) Quais são isótonos? c) Quais são isóbaros? 3. O átomo X é isóbaro do 40 Ca e isótopo do 18 Ar. Qual o número de neutrões do átomo X? Exercícios (TPC)
a) O n° atómico b) O n° de massa c) O n° de protões d) O n° de electrões e) O n° de neutrões 1. Dado o átomo 11 Na 23 pede-se: A= Z+N e sabe-se que Z= p
= e
→ Resp: Z = 11 → Resp: A = 23 → Resp: p
= 11 → Resp: e
= 11 → Resp: N = 12 Correcção de Exercícios