










Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
ligações quimicas
Tipologia: Notas de estudo
1 / 18

Esta página não é visível na pré-visualização
Não perca as partes importantes!











São uniões estabelecidas
entre átomos para formarem as moléculas,
que constituem a estrutura básica de
uma substância ou um composto.
Os átomos destes elementos
químicos ao se unirem formam a grande
diversidade de substâncias químicas.
Em todos os tipos de ligações químicas
as forças de ligação são essencialmente
eletrostáticas (ou de Coulomb), isto é,
forças entre cargas elétricas.
C gostaria de
N gostaria de
O gostaria de
H gostaria de
ganhar 4 elétrons
ganhar 3 elétrons
ganhar 2 elétrons
ganhar 1 elétron
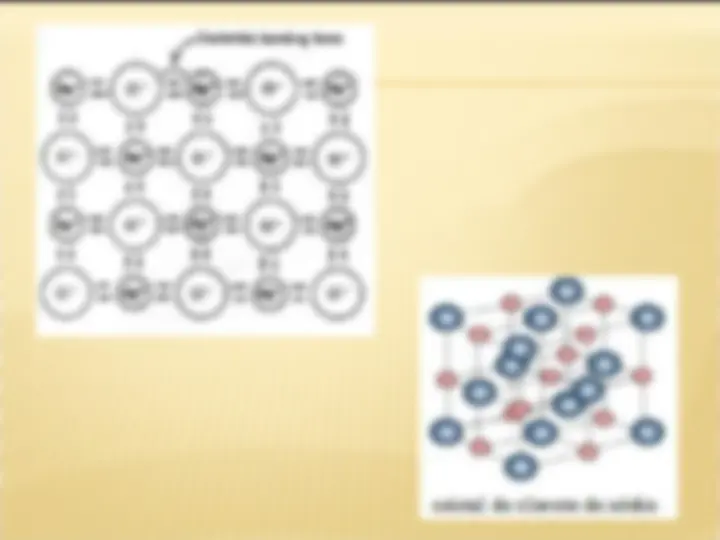
Caracterizada pela transferência
de elétrons.
Ocorre entre: METAL e AMETAL
METAL e HIDROGÊNIO
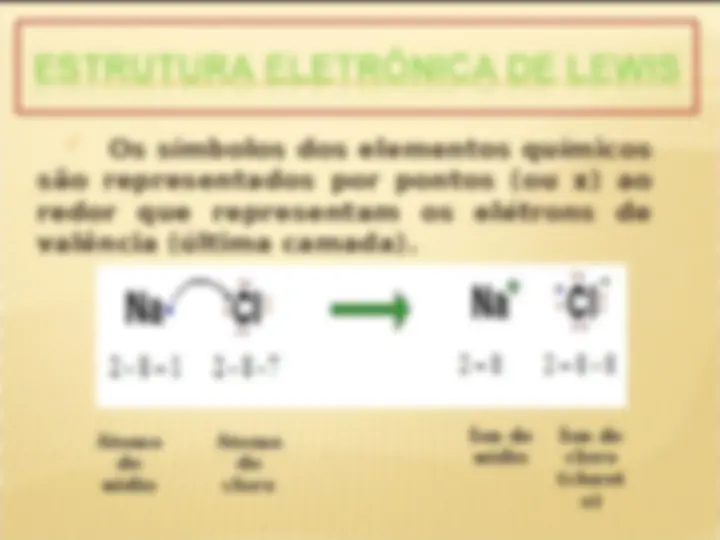
Os símbolos dos elementos químicos
são representados por pontos (ou x) ao
redor que representam os elétrons de
valência (última camada).
Átomo
de
sódio
Átomo
de
cloro
Íon de
cloro
(cloret
o)
Íon de
sódio