












Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
fisica termodinamica
Tipologia: Notas de estudo
1 / 87

Esta página não é visível na pré-visualização
Não perca as partes importantes!
















































































Conceitos e definições
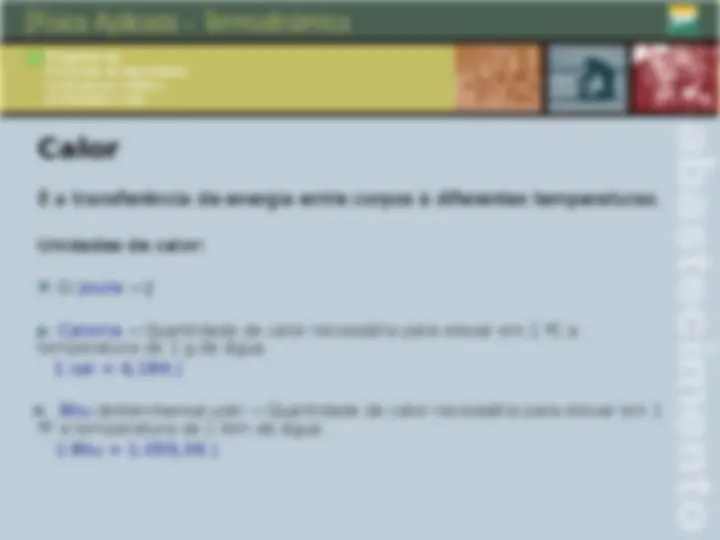
Calor É a transferência de energia entre corpos à diferentes temperaturas. Unidades de calor: SI:Joule J Caloria Quantidade de calor necessária para elevar em 1 ºC a temperatura de 1 g de água. 1 cal = 4,186 J Btu ( British thermal unit ) Quantidade de calor necessária para elevar em 1 ºF a temperatura de 1 lbm de água. 1 Btu = 1.055,06 J
Propriedade
Características macroscópicas de um sistema: não dependem da história do sistema; a mudança de seu valor entre dois estados é independente do processo.
massa, volume, energia, pressão e temperatura.
Estado
Condição do sistema, como descrito por propriedades macroscópicas observáveis. O estado pode ser caracterizado por um subconjunto de propriedades.
Processo e Ciclo
É o caminho definido pela sucessão de estados através dos quais o sistema percorre. Para ocorrer uma mudança de estado, é necessário que pelo menos uma propriedade do sistema se altere.
Seqüência de processos que começam e terminam em um mesmo estado.
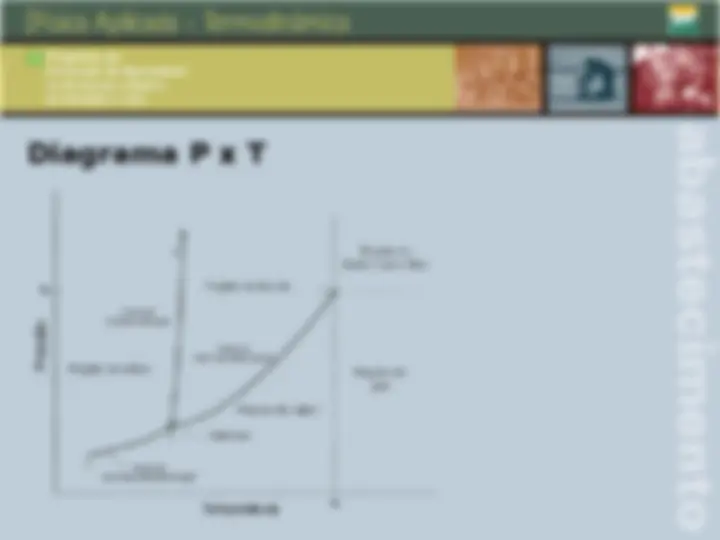
Diagrama P x T
Propriedades críticas Propriedades críticas de algumas substâncias: Substância Temperatura crítica (K) Pressão crítica (kgf/cm^2 ) Água 647,3 225, Ácido acético 594,8 59, Bromo 584 105, Etanol 516,3 65, Metanol 513,2 81, Acetona 508,0 48, Dióxido de carbono 304,2 75, Metano 190,7 88, Monóxido de carbono 133,0 35, Ar 132,5 38, Hidrogênio 33,3 13,
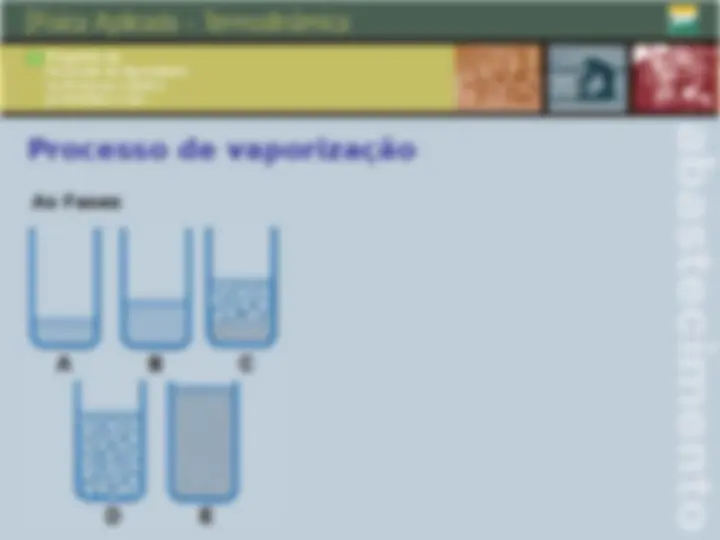
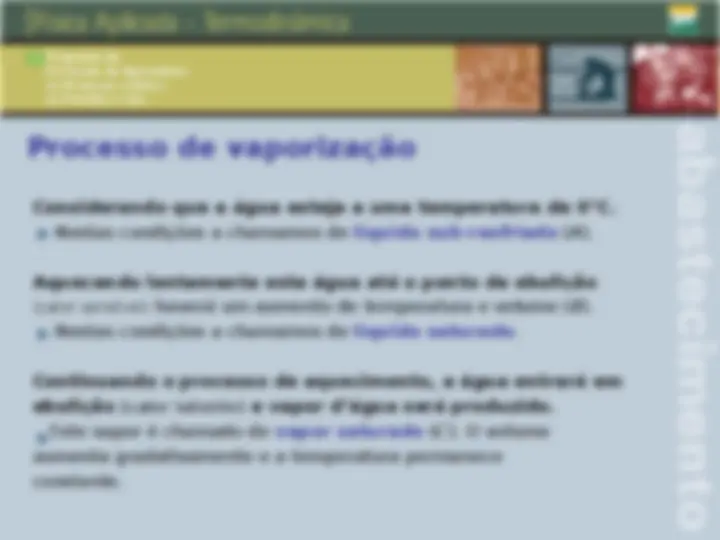
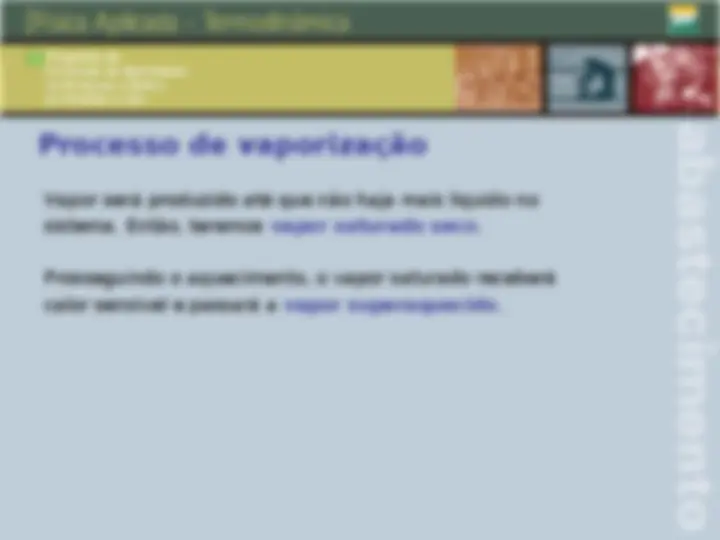
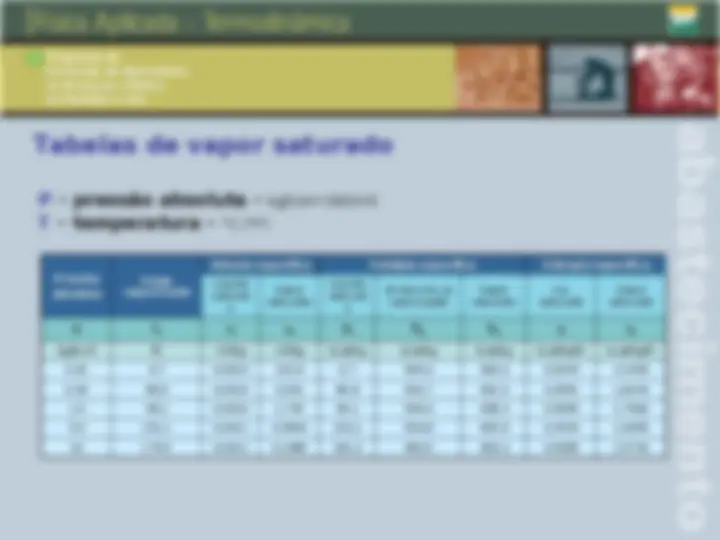
Qualidade, ponto de orvalho e ponto de bolha Qualidade: é a fração em massa do vapor na mistura deste com O seu líquido em equilíbrio. Ponto de orvalho: ponto em que inicia a condensação quando A temperatura é reduzida a pressão constante, para um sistema De composição invariável. Ponto de bolha: temperatura na qual o líquido puro ou uma solução inicia a evaporação quando é submetido a um aquecimento a pressão constante.
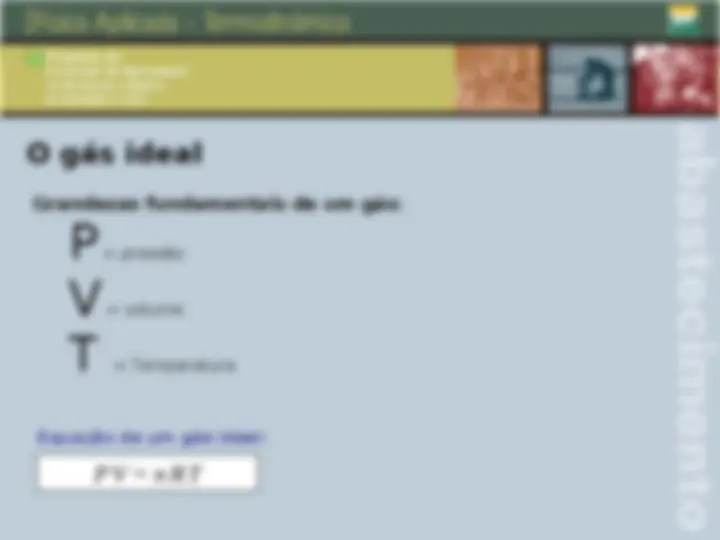
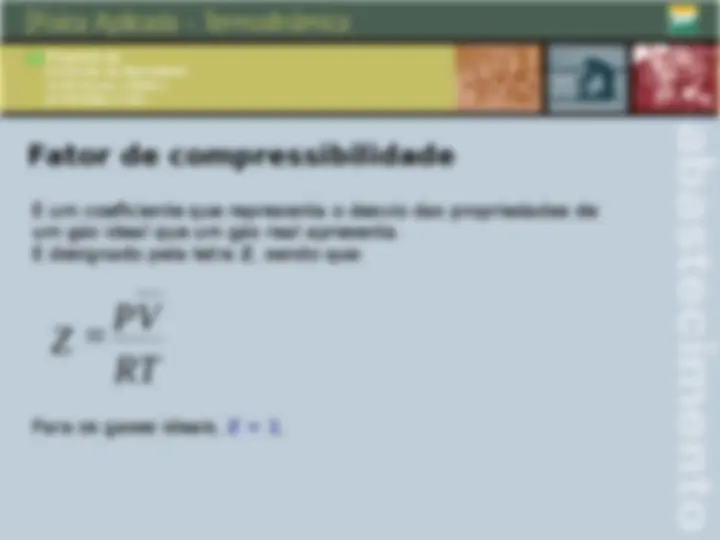
O gás ideal Grandezas fundamentais de um gás: P = pressão V = volume T = Temperatura P . V = n . R . T Equação de um gás ideal:
Desvios da idealidade:
Pressão Considera-se um recipiente cilíndrico, que contém um gás ideal, provido de um êmbolo, de área A, que pode deslocar-se sem atrito, submetido a uma força resultante de intensidade F exercida pelo gás, como mostra a figura. A pressão que o gás exerce sobre o êmbolo é dada por: F P A F
P
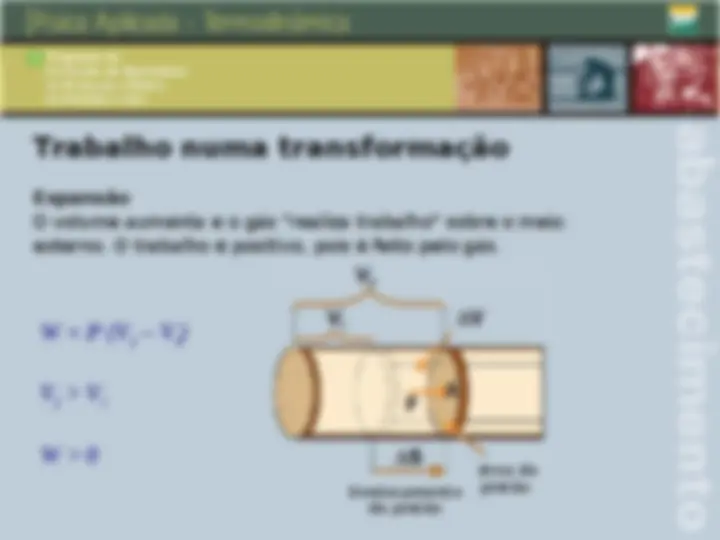
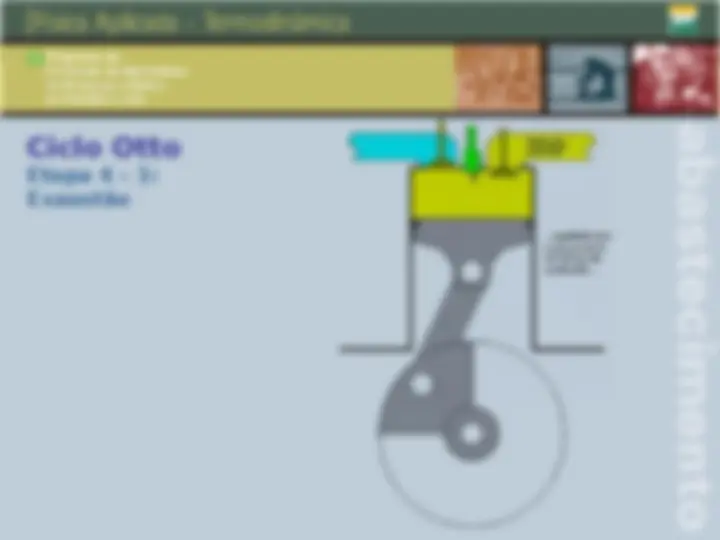
Trabalho numa transformação Compressão O volume diminui e o gás “recebe trabalho“ do meio externo. W = P (V f
- V i ) V f < V i W < 0 Deslocamento do pistão área do pistão
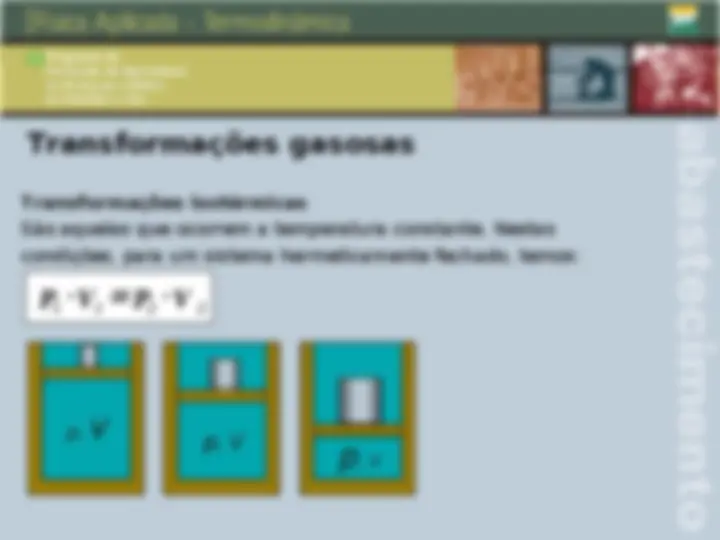
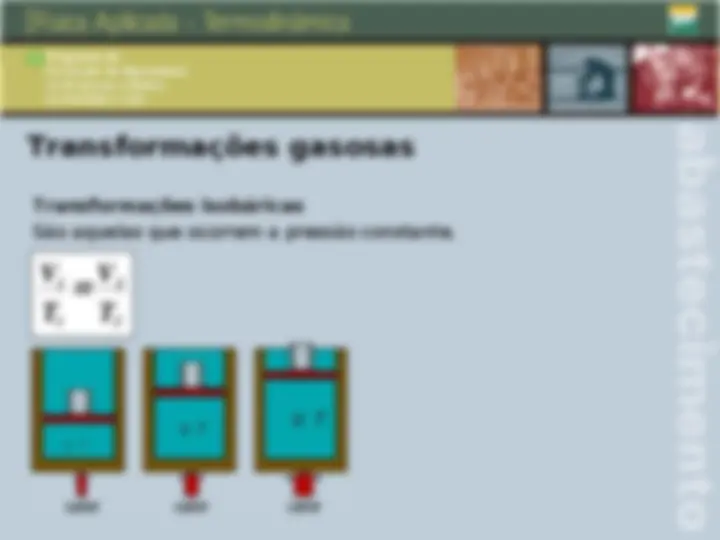
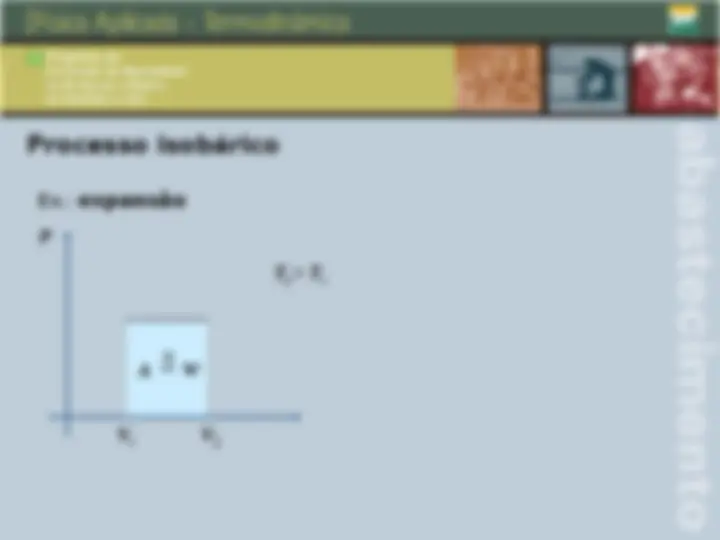
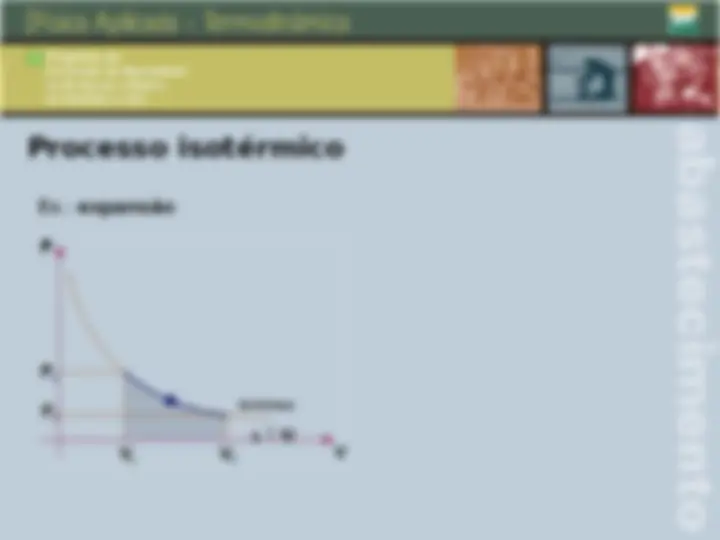
Transformações gasosas Transformações isotérmicas São aquelas que ocorrem a temperatura constante. Nestas condições, para um sistema hermeticamente fechado, temos: P 1 V 1 P 2 V 2