
































Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
O ponto importante nesta Tabla é a correlação elétron envolvido/energia do orbital antiligante/valor de ... Uso do ponto isosbéstico para fins mecanísticos.
Tipologia: Notas de estudo
Compartilhado em 07/11/2022
4.6
(84)74 documentos
1 / 41

Esta página não é visível na pré-visualização
Não perca as partes importantes!


































Cores complementares: Combinação aditiva (branco) ; combinação subtrativa (cinza ou preto).
1
A razão de usar a absorbância e não a % transmitância é que a última escala não é linear no comprimento do caminho óptico.
Cromóforo : Um grupo insaturado covalente , responsável pela absorção eletrônica (ex: C=C; C=O, NO 2 ).
Grupo cromóforo Composto λλλλ max; nm -C=C- H 2 C=CH 2 180 Anel aromático Benzeno 255 -C=O Acetona 277 -N=N- Me-N=N-Me 347 -C=S Me 2 C=S 400 -N=O C 4 H 9 N=O 665
Valores de λ max de grupos cromóforos típicos
A conjugação de cromófores aumenta λλλλ max e (^) εεεε max
Composto λλλλ max, nm
εεεε max, Lmol- (^1) cm- λλλλ max, nm
εεεε max, Lmol- cm- H 2 C=CH 2 180 10000 H 2 C=CH-CH=CH 2 217 210000 H 2 C=O 180 10000 273 12 H 2 C=CH-CH=O 217 160000 321 20
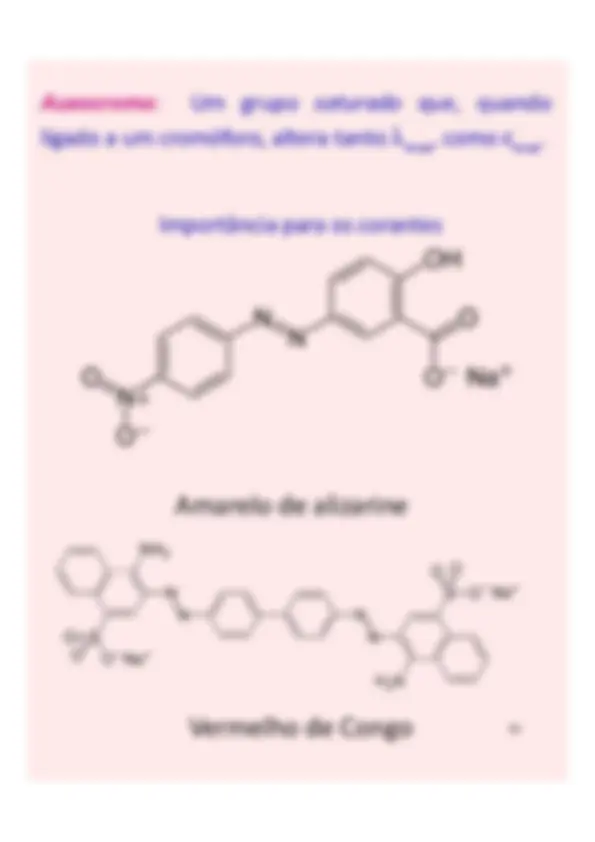
Amarelo de alizarine
Vermelho de Congo
10
Deslocamento Batocrômico: desclocamento de λλλλ max para valores maiores , em relação a um composto de referência ou de partida. Também chamado deslocamento para o vermelho****. Deslocamento Hipsocrômico : deslocamento de λλλλ max para valores menores , em relação a um composto de referência ou de partida. Também chamado deslocamento para o azul. Efeito Hipercrômico : É um aumento da intensidade da absorção Efeito Hipocrômico : É uma diminuição da intensidade da absorção.
O efeito de auxocromos foi estudado extensivamente em sistemas orgânicos; observou-se a ordem: O -^ > NHMe > NH 2 , OH > Cl > CH 3 > NH 3 +^ , H Esta ordem de (G) concorda (aproximadamente) com que sabemos sobre reações de substituição S E Ar em G-Ph?
14