









Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
efe nskdfnxz, ndklvcn asjx pposdj jd bvsdczcas shhbcs ehn auwb ioan h ihsd. ksn a bsacn io jkn bu iu odjchi cnjkìjcnkioj ộ
Tipologia: Notas de aula
1 / 14

Esta página não é visível na pré-visualização
Não perca as partes importantes!









MEDIDAS CUANTITATIVAS DE LA POBLACIÓN BACTERIANA EN SUELOS 3 RECUENTOS DE BACTERIAS VIABLES 3 RECUENTO DE BACTERIAS AEROBIAS MESÓFILAS: 4 TOMA DE MUESTRA 5 DILUCIONES: 6 MÉTODO DE RECUENTO EN PLACA DE SIEMBRA POR DISEMINACIÓN EN SUPERFICIE: 9 EN MEDIO LÍQUIDO: DETERMINACIÓN DEL NÚMERO MAS PROBABLE (NMP) DE MICROORGANISMOS POR ML, G / O 100 ML. (MEDIO LÍQUIDO) MÉTODO POCO USADO EN SUELOS. 10 TABLA 1: NÚMERO MÁS PROBABLE (NMP) DE BACTERIAS EN ALIMENTOS, (TRES TUBOS POR CADA DILUCIÓN): 13
Variando estos factores, podemos obtener una amplia variedad de condiciones que favorecen el desarrollo de bacterias con distintas características ó de distintos géneros. Comúnmente se usa el denominado "Recuento de bacterias aerobias mesófilas". Este método se describirá a continuación y es aplicable a otros grupos de microorganismos, sólo con cambiar el medio de cultivo y las condiciones de incubación.
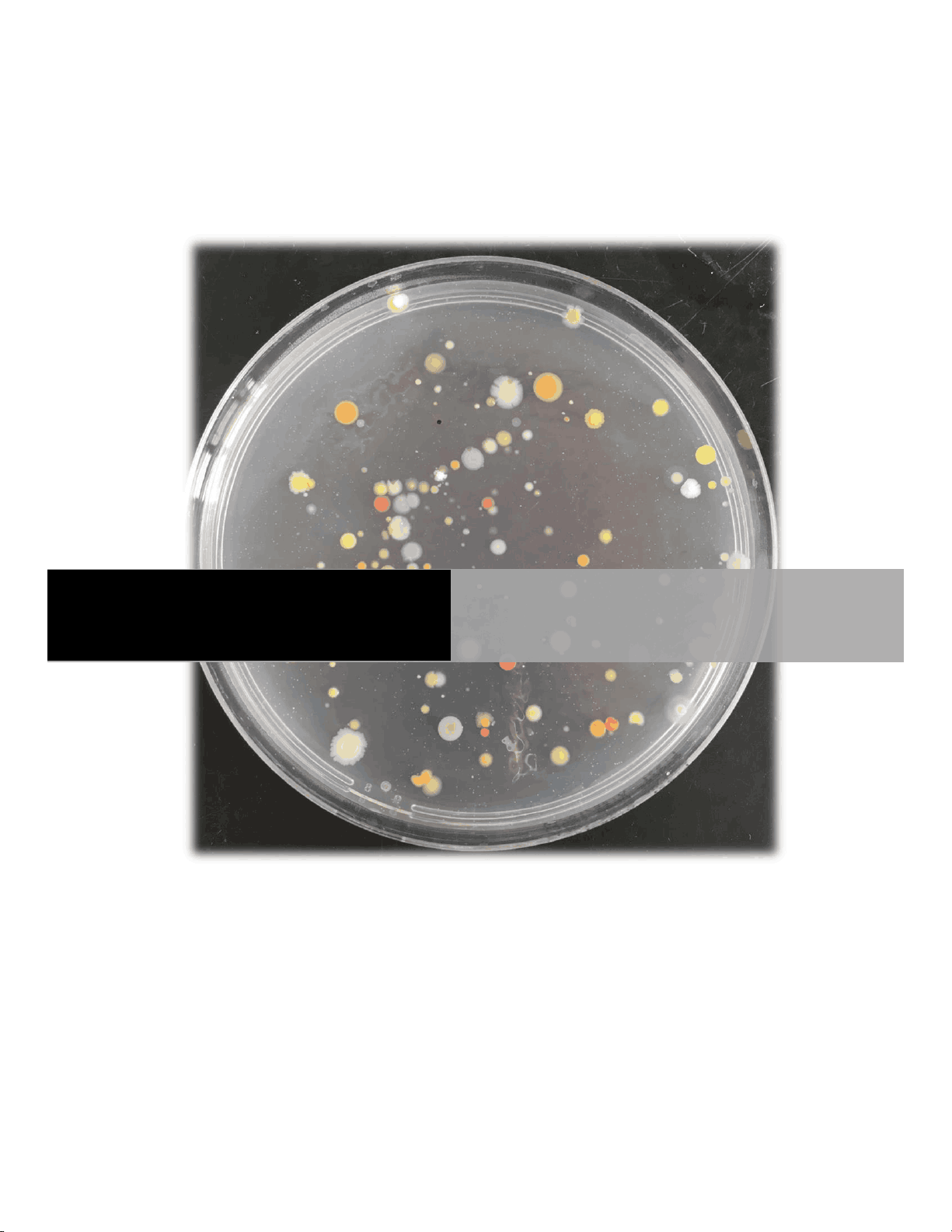
Método de recuento en placa por siembra por volcado: (ver esquema 1): Fundamento: En este procedimiento se introduce una cantidad medida (generalmente 1 ml) del líquido ó dilución del sólido en una caja de Petri. Se adiciona agar fundido y enfriado a 45º suave, mediante agitación rotatoria de la caja se mezcla el inóculo con el agar. Cuando el medio se solidifica los microorganismos quedan atrapados en el agar. Luego de la incubación cada microorganismo desarrolla formando una colonia. La cuenta de colonias en la placa indica el número de unidades formadoras de colonias. La muestra original se diluye de tal manera que se desarrollen entre 30 y 300 colonias, entre estas cantidades la cuenta es más exacta y la posibilidad de interferencia entre los microorganismos es mínima. Si la suspensión bacteriana es homogénea cada microorganismo dará origen a una colonia, si contiene conglomerados de células, es decir que la bacteria tiene tendencia a formar racimos o cadenas, el número de colonias será menor que el número de células individuales, pues cada conglomerado formara una colonia. Por ello los resultados se expresan en "U.F.C.". Este método es aplicable para alimentos, agua, leche y diversos productos. No es recomendable para las muestras ambientales pues la temperatura del agar fundido puede afectar la viabilidad de este tipo de bacterias. Diferentes factores que influyen en el resultado: *** Medio de cultivo, composición, presencia de inhibidores.
Toma de muestra Lo primero que se debe hacer a la hora de tomar muestras es el dise ñ o, este debe estipular la forma y el n ú mero de muestras a tomar teniendo en cuenta que debe recogerse una muestra por cada porció n de terreno con características particulares. Las muestras deben ser tomadas al azar, recorriendo la parcela o el lote en cuadr ículas, zigzag o diagonales o sobre el trazado de una transecta lineal. La transecta es una lí nea recta imaginaria con puntos de muestreo localizados a intervalos regulares. La muestra puede ser, una muestra simple: es la que se obtiene mediante una sola extracción. Generalmente, este tipo de muestreos no se llevan a cabo a campo debido a la gran heterogeneidad del suelo. O una muestra compuesta, que se refiere a la muestra de suelo y/o rastrojo obtenida por la extracción de varias muestras simples o submuestras, reunidas en un recipiente o bien mezcladas (homogeneizadas) de aproximadamente 0,5 a 1 Kg de suelo. Se recomienda la extracci ó n de 15- 20 submuestras por sitio de muestreo. El peso de cada submuestra debe ser de aproximadamente 200 gramos de suelo o por lo menos de igual volumen que las dem ás submuestras. En el caso de rastrojo se colecta x 40 cm). La utilizació n de muestras compuestas para el análisis es un efectivo mé todo para obtener una adecuada estimaci ó n de la media de un par ámetro reduciendo los costos y tiempo de aná lisis. Las muestras compuestas: a) deben ser homog é neas; b) cada submuestra debe contribuir de igual manera (mismo volumen) a la muestra compuesta; c) cada submuestra debe ser tomada siguiendo el mismo procedimiento en cuento a instrumento utilizado, profundidad, etc.; y d) las submuestras deben ser independientes y no presentar interacción. Acondicionamiento de las muestras En el campo las muestras deben ser colocadas en bolsas de polietileno o frascos de vidrio bonca ancha estériles, debidamente rotuladas y acondicionadas en una conservadora hasta su llegada al laboratorio. De esta manera, se evita que sufran exceso de calor e insolación y que se alteren sus condiciones originales. El ró tulo de cada muestra estará identificado (letras o números) y hora y fecha, ubicación precisa, GPS, y cadena de custodia. Al llegar al laboratorio se las muestras compuestas se trabajan para homogenizar y se separaran por cuarteos. Luego se requiere un tratamiento previo de la muestra para liberar a un medio fluido los microorganismos aprisionados en el interior de la muestra. Es importante controlar la velocidad del homogeneizador para que no destruya las células microbianas y el tiempo debe ser suficiente para liberar las bacterias y conseguir una distribución uniforme, generalmente se realiza durante 2 min.
2. Incubación: Dejar solidificar el agar y secar las placas en posición invertida y abiertas en una estufa a 37ºC durante 30 min. Incubar a 35 - 37ºC durante 24 - 48 hs. 3. Cálculo de recuento: Elegir dos placas correspondientes a una dilución que presente entre 30 y 300 colonias. Contar todas las colonias de cada placa. Se puede utilizar un contador de colonias con un dispositivo de luz y una lupa que aumente 2-3 veces el diámetro de la colonia. Hallar la media aritmética de los dos valores y multiplicar por el factor de dilución, que es la inversa de la dilución de las placas seleccionadas. Por ej.: si la placa seleccionada es 10-^2 multiplicar por 100, 10-^3 multiplicar por 1000, etc. Informar los valores como U.F.C. por unidad de peso, unidad de volumen o unidad de superficie, según corresponda (ver esquema 1):
Tener en cuenta el factor de dilución a sembrar (0,1 ml en lugar de 1 ml), por lo que además de multiplicar por la dilución, se multiplica también por 10. En medio líquido: Determinación del Número mas probable (NMP) de microorganismos por ml, g / o 100 ml. (Medio líquido) método poco usado en suelos. Este método se utiliza cuando la muestra presenta baja carga bacteriana. Permite detectar hasta 1100 microorganismos por g, ml ó 100 ml, según si se trata de muestras sólidas o líquidas. Técnica: (Ver esquema 2)
1. Inoculación: En este práctico se utilizará caldo nutritivo, distribuido en 9 ml. en tubos de ensayo. Se inocula 1 ml de cada una de las diluciones de la muestra en los tubos de ensayo, utilizando tres tubos por dilución. 2. Incubación: Se incuba 24-48 hs. a 35-37ºC en baño termostatizado. 3. Lectura: Los tubos con crecimiento se observan como turbidez visible del medio de cultivo. 4. Cálculo: Para determinar el N.M.P., considerar la dilución más alta en la que los tres tubos presentaron crecimiento y las dos diluciones superiores más próximas. Con ese número obtenido ir a la tabla para determinar el N.M.P. Ejemplo: Dilución Nº de tubos positivos 1: 100 3 1: 1.000 1 1:10.000 0 Estos resultados corresponden en la tabla de N.M.P. a 400 microorganismos por gramo o por ml.
Para calcular el NMP de diluciones mayores que las que figuran en la Tabla (10-1, 10- 2 y 10-3), multiplicar el NMP por el factor adecuado : 10, 100, 1000, etc. Por ejemplo, si los tubos seleccionados corresponden a las diluciones 10-2, 10-3 y 10-4, multiplicar por 10; si las diluciones son 10-3, 10-4 y 10-5, multiplicar por 100.
TABLA 1: Número más probable (NMP) de bacterias en alimentos, (tres tubos por cada dilución): Nº de tubos positivos en cada dilución Dilución Dilución Dilución. NMP por Límites de confianza 10 -^1 10 -^2 10 -^3 gramo 99% 95% (^0 1 0 3) 1 23 1 17 1 0 0 4 1 28 1 21 1 0 1 7 1 35 2 27 1 1 0 7 1 36 2 28 1 2 0 11 2 44 4 35 2 0 0 9 1 50 1 38 2 0 1 14 3 62 5 48 2 1 0 15 3 65 5 50 2 1 1 20 5 77 8 61 2 2 0 21 5 80 8 63 3 0 0 23 4 177 7 129 3 0 1 40 10 230 10 180 3 1 0 40 10 290 20 210 3 1 1 70 20 370 20 280 3 2 0 90 20 520 30 390 3 2 1 150 30 660 50 510 3 2 2 210 50 820 80 640 (^3 3 0 200) 100 1900 100 1400 3 3 1 500 100 3200 200 2400 3 3 2 1100 200 6400 300 4800 Calculada a partir de los datos de MAN (1975). De cada dilución se inoculan tres tubos de medio, cada uno con 1 ml.
Recuento en placa por diseminación en superficie y volcado. Recuento por determinación del número más probable (NMP) de las muestras provistas por la cátedra.