

















































Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
Compostos de coordenação
Tipologia: Slides
1 / 58

Esta página não é visível na pré-visualização
Não perca as partes importantes!



















































1 ° Semestre 2015
Reações dos Compostos de Coordenação
A dinâmica das reações químicas é controlada por dois fatores:
Termodinâmicos: Referem-se às possibilidades das reações
acontecerem;
Cinéticos: Relacionam-se aos mecanismos e às velocidades com que as
reações acontecem.
Fatores termodinâmicos:
Variação de entalpia (∆H) - relaciona ao conteúdo energético das
espécies envolvidas.
Variação de entropia (∆S) - Relaciona-se com o estado de desordem do
sistema.
Variação de Energia livre (∆G) - parâmetro determinante da ocorrência
das reações. É obtido pela combinação dos dois primeiros:
Velocidade de Substituição de Ligante
Nucleofilicidade
A velocidade com que um complexo converte-se em outro é governada pelo tamanho da barreira de energia de ativação que existe entre eles.
Ligante Não-Lábil Ligante Lábil
Basicidade Cinética
Velocidades das Reações de Substituição de Ligante
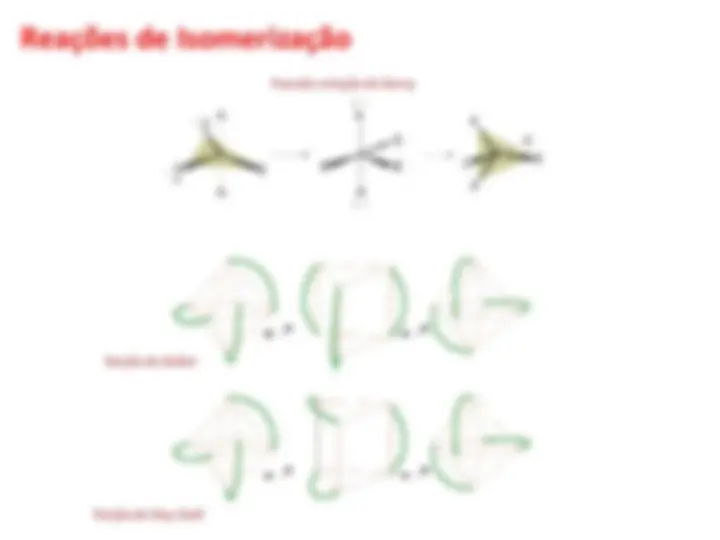
Mecanismos para Reações de Substituição Nucleofílica
Coordenada de reação Coordenada de reação
Mecanismo Dissociativo (D) Mecanismo Associativo (A)
Mecansimo Troca (I)
MLnX MLn + X MLn + Y MLnY
MLnX + Y MLnXY MLnXY MLnY + X
MLnX + Y X -- MLn -- Y MLnY + X
Coordenada de reação
Substituição dos Ligantes em Complexos
Classificação dos Mecanismos
MLnX → MLn + X
MLn + Y → MLnY
Substituição Nucleofílica Unimolecular (SN 1 )
W(CO) 5 + PPh 3 → W(CO) 5 PPh 3
Lei de Velovidade: v = k. [W(CO) 6 ]
Formação de um intermediário com número de coordenação menor que no complexo
original.
Lei de Velovidade: v = k. [MLnX]
Substituição dos Ligantes em Complexos
Classificação dos Mecanismos
Grupos de saída e entrada são trocados numa única etapa. Formação de um
estado de transição.
MLnX + Y → X---MLn---Y → MLnY + X
Lei de Velovidade: v = k. [MLnX][Y]
Substituição Nucleofílica Bimolecular (SN 2 )
Velocidades das Reações de Substituição de Ligante
Reações de Substituição de Ligantes
n
q n n ML X
MX L K {[ ] }.[ ]
{[ ] }.[ ]
[M(H 2 O) 6 ]n+(aq) + L (^) (aq) [M(H 2 O) 5 L]n+(aq) + H 2 O(l)
[M(H 2 O) 5 ]n+(aq) + L (aq) [M(H 2 O) 4 L]n+(aq) + H 2 O(l)
[M(H 2 O)L 5 ]n+(aq) + L (aq) [ML 6 ]n+(aq) + H 2 O(l)
[M(H 2 O) 6 ]n+(aq) + 6L (aq) [ML 6 ]n+(aq) + 6H 2 O(l)
{[ ( ) ] }.[ ]
{[ ( ) ] } 2 5
2 2 4 2 M H O L
K M H O L n
n
{[ ( ) ] }.[ ]
{[ ( ) ] } 2 6
1 2 5 M H O L
K M H O L n
n
{[ ( ) ] }.[ ]
{[ ] } 2 5
6 6 M H O L L
K ML n
n
6 2 6
6 (^1 23456) {[ ( ) ] }[ ]
{[ ] }
..... M H O L
ML K K K K K K K K n
n
Estabilidade dos Complexos
De que fatores depende a estabilidade de um complexo?
{[ ( ) ] }.[ ]
{[ ( ) ( )] } 2
1 2 1 M H O OH
M H O OH K (^) q n
q n