


















































































Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
precursores para carvão ativado para remoção de ferro
Tipologia: Teses (TCC)
1 / 89

Esta página não é visível na pré-visualização
Não perca as partes importantes!


















































































Dissertação apresentada ao Curso de Pós- Graduação em Engenharia Química do Centro Tecnológico da Universidade Federal de Santa Catarina como requisito parcial para a obtenção do título de Mestre em Engenharia Química.
Banca Examinadora:
Prof. Dra. Regina de F. P. M. Moreira (Orientadora)
Prof. Dr. Humberto Jorge José (Co-orientador)
Prof. Dr.Marcelino Luiz Gimenes
Prof. Dr. Antônio Augusto Ulson de Souza
3.4.6 Leitos de contato – zeólita impregnada com óxido de manganês
5.1.1 Desenvolvimento e seleção do adsorvente 44 5.1.2 Caracterização do carvão CARBOTRAT AP 50 5.1.3 Remoção de íons metálicos com carvão CARBOTRAT AP 53 5.1.4. Remoção de ferro com carvão CARBOTRAT AP 58 5.1.4.1. Remoção de ferro com carvão CARBOTRAT AP em meio oxigenado e em meio desoxigenado
5.1.4.2. Remoção de ferro com carvão CARBOTRAT AP, Birm e Controllmaster
5.1.4.3. Cinética de remoção de ferro em batelada com carvão CARBOTRAT AP
5.1.4.4. Remoção de ferro em leito fixo de carvão CARBOTRAT AP
5.2 Testes em escala piloto sem aeração 70 5.2.1 Remoção do ferro presente na água do poço – Primeiro ciclo de Adsorção/Filtração
5.2.2 Remoção do ferro presente na água do poço – Segundo ciclo de Adsorção/Filtração
5.2.3 Remoção do ferro presente na água do poço – Terceiro ciclo de Adsorção/Filtração
5.3 Teste em escala piloto com aeração – Quarto ciclo de Adsorção/Filtração
5.4 Teste em larga escala 80
6. CONCLUSÕES 83 7. REFERÊNCIAS BIBLIOGRÁFICAS 85 8. ANEXOS 89
Figura 1– Mecanismo de oxidação de Fe2 +^ na superfície de carvão ativado (Rönnholm et al., 1999).
Esquema 3 - Unidade Piloto I. 38 Esquema 4 - Unidade piloto II. 40 Figura 5 – Filtros de carvão CARBOTRAT AP instalados no município do Ermo / SC
Figura 6 - Adsorção de N 2 sobre carvão CARBOTRAT AP a 77K.
Figura 7 - Plote DR do carvão CARBOTRAT AP. 52 Figura 8 – Equilíbrio da remoção dos metais Fe2 +^ , Zn2 +^ e Al3 + com carvão CARBOTRAT AP em batelada.
Figura 9 – Equilíbrio da remoção dos metais Mn2 +^ , Cu+^ e Cr6 + com carvão CARBOTRAT AP.
Figura 10 – Equilíbrio da remoção de ferro com carvão CARBOTRAT AP em meio oxigenado e desoxigenado.
Figura 11 – Segundo ciclo de remoção de ferro em carvão CARBOTRAT AP saturado.
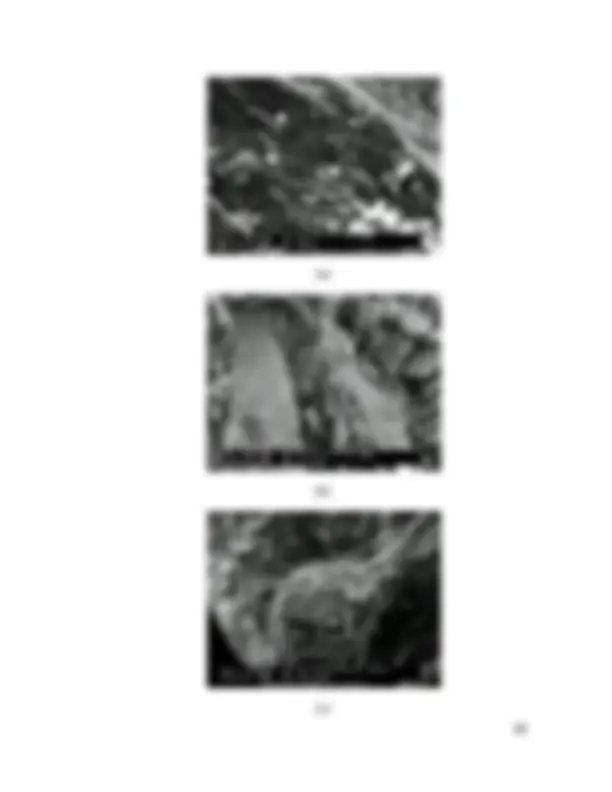
Figura 12 - Microscopia de varredura eletrônica do carvão CARBOTRAT AP antes e após o uso para a remoção de íons ferro em solução aquosa. (a) Virgem; (b) Saturado; (c) Detalhe do carvão saturado.
Figura 13 – Remoção de íons ferro em meio oxigenado com carvão CARBOTRAT AP, Birm e Controllmaster.
Figura 14 - Cinética de remoção de ferro em carvão CARBOTRAT AP.
Figura 15 - Concentração de ferro na água à saída do leito de carvão CARBOTRAT AP.
Figura 16 – Água do poço contaminada com ferro após contato com oxigênio.
Figura 17 - Concentração de ferro e manganês na saída do filtro de carvão em função da quantidade de água tratada no primeiro teste de adsorção.
Figura 18 – Captação de água para a retrolavagem do carvão. 73 Figura 19 - Concentração de ferro na saída do filtro de carvão em função da quantidade de água tratada no segundo teste de adsorção.
Figura 20 - Variação da concentração de ferro na saída do leito de carvão durante a retrolavagem.
Figura 21 - Concentração de ferro na saída do filtro de carvão em função da quantidade de água tratada no terceiro teste de adsorção.
Figura 22 - Concentração de ferro na saída do filtro de carvão no quarto ciclo de adsorção/filtração - aeração, filtro de areia e filtro de carvão.
Tabela 15 - Análises na água tratada do Ermo / SC antes da adição dos filtros de carvão.
Tabela 16 - Água tratada do ERMO após a adição dos filtros de carvão CARBOTRAT AP.
Este trabalho teve como objetivo o desenvolvimento de um novo carvão adsorvente a partir do carvão mineral de Santa Catarina, a ser utilizado para o tratamento de águas naturais. Foram testados vários tipos de carvão mineral, com diferentes quantidades de cinzas, e carvões minerais submetidos a diferentes processos de beneficiamento. Foi desenvolvido um carvão mineral beneficiado que apresentou bons resultados para remoção de íons metálicos em águas, com ênfase na remoção de íons ferro, um problema muito comum encontrado nas águas subterrâneas no Estado de Santa Catarina. Foram realizados testes da sua utilização para a remoção de íons ferro em águas naturais, avaliando-se seu potencial inicialmente em escala de bancada, seguindo-se para a escala piloto, iniciando-se finalmente sua aplicação industrial.
O equilíbrio da remoção de íons ferro foi descrito usando-se o modelo de Langmuir, o qual assume cobertura em monocamada. Na ausência de oxigênio dissolvido, Fe2 +^ é adsorvido na superfície do carvão, formando uma monocamada de 1,93 mg/g, enquanto a monocamada de ferro oxidado no sistema aerado é de 2,07 mg/g. A remoção de íons ferro resulta da adsorção de oxigênio seguida pela oxidação de Fe2 +^ , catalisada pela superfície do carvão. Os íons Fe3 +^ precipitam-se sobre o sólido, formando uma cobertura sobre o carvão adsorvente, também capaz de adsorver ferro solúvel.
A cinética de remoção de íons ferro foi modelada utilizando-se o modelo de difusão no filme e poros. Testes em escala piloto, realizados com e sem aeração, mostraram resultados similares àqueles obtidos em escala de bancada. Testes realizados em grande escala mostraram que a retrolavagem é suficiente para recompor a capacidade de remoção de íons ferro do carvão adsorvente.
In this work, we develop a new adsorbent carbon to be used in the iron removal to drinking water.
Several mineral coals with different ash contend and pre-treatments are tested. This adsobents were tested to remove Zn+ 2^ , Al+ 3^ , Mn+ 2^ , Cr+ 6^ , Cu+ 2^ and Fe+ 2^.
A adsorbent carbon with point of zero charge near neutral was selected due its high iron removal capacity, and was named CARBOTRAT AP.
Tests in bench scale, pilot and industrial scale were performed to explain the mechanism of iron removal. In the absence of dissolved oxygen, Fe+ 2^ is adsorbed in the carbon surface, forming a monolayer of 1.93 mg/g, white the monolayer of oxidized iron in the air-equilibrated system was 2.07 mg/g. The iron removal is consequence of the oxygen adsoption followed by the F2+ 2^ oxidation, catalyzed by the carbon surface. The ions Fe+ 3^ precipitades on the solid, forming an iron-oxide coated carbon, that also adsorbs soluble iron.
The kinetics of iron removal was modeled using the film and pore diffusion model.
Tests in pilot scale were carried out with and without pre-aeration. The results showed the same behaviour that than bench scale.
A industrial filter was to treat 10 m^3 /h of drinking water. The capacity of the filter ca be regenerated through periodicals backwashing.
As tecnologias tradicionais de tratamento de água potável (coagulação, floculação, decantação, filtração e desinfecção) muitas vezes não são eficientes na remoção de traços de metais solúveis em águas.
Geralmente os íons metálicos solúveis são removidos da água por precipitação. Porém, a remoção dos metais, na forma de óxidos, hidróxidos, carbonatos ou sulfatos, a qual é obtida através da adição de coagulantes, apresenta algumas desvantagens, entre as quais podemos citar: precipitação ineficiente se os metais estão complexados ou na forma de ânions; a menor concentração do metal alcançada é limitada pelo produto de solubilidade; grande quantidade de lodo é gerada após a decantação; necessidade de uma posterior filtração para remoção dos sólidos suspensos e clarificação da água tratada.
A filtração concomitantemente com a adsorção, com um adsorvente adequado, pode apresentar algumas vantagens, entre as quais podemos citar: remoção de cátions metálicos complexados ou não; redução dos teores de metais a níveis muito inferiores aos alcançados com a coagulação; baixo custo operacional, se não houver a necessidade de regeneração ácida ou alcalina do adsorvente; redução drástica na quantidade de lodo gerado; produção de água filtrada de ótima qualidade.
Os íons ferro e manganês, freqüentemente encontrados em águas subterrâneas, são os materiais mais abundantes da crosta terrestre. Dentre os minérios de ferro mais encontrados, podemos citar: hematita (Fe 2 O 3 ), magnetita (Fe 3 O 2 ), calcopirita (CuFeS 2 ) e a pirita (FeS 2 ).
O ferro presente nas águas pode estar no estado de oxidação +2 ou +3. O íon ferroso (Fe+ 2^ ) é mais solúvel do que o íon férrico (Fe+ 3^ ).
O objetivo deste trabalho é desenvolver um novo carvão adsorvente para ser utilizado no tratamento de água potável, verificando a sua eficiência na remoção de íons ferro, um problema bastante comum em águas subterrâneas.
O uso de carvão mineral para o tratamento de água potável é justificável, pois as reservas totais de carvão no Brasil são da ordem de 22 bilhões de toneladas distribuídas entre os três estados da Região Sul do País. O carvão ainda tem a vantagem de ser utilizado posteriormente como fonte de energia após o processo de tratamento.
Os objetivos específicos são:
Recurso natural de valor econômico, estratégico e social, essencial à existência e bem-estar do homem e à manutenção dos ecossistemas do planeta, a água é um bem comum a toda a humanidade. Isto significa que todo ser vivo tem direito inerente a obtê-la em um grau de pureza compatível com suas próprias exigências orgânicas.
Durante milênios a água foi considerada como sendo um recurso infinito. A generosidade da natureza fazia crer em inesgotáveis mananciais, abundantes e renováveis. Hoje, o mau uso, aliado à crescente demanda pelo recurso, vem preocupando especialistas e autoridades no assunto pelo evidente decréscimo da disponibilidade de água limpa em todo o planeta. A Tabela 1 apresenta a disponibilidade de água por habitante e região ao longo de 50 anos.
Tabela 1 - Disponibilidade de água; (m^3 /habitante)/região. REGIÃO 1950 1960 1970 1980 2000 África 20,6 16,5 12,7 9,4 5, Ásia 9,6 7,9 6,1 5,1 3, América Latina 105,0 80,2 61,7 48,8 28, Europa 5,9 5,4 4,9 4,4 4, América do Norte 37,2 30,2 25,2 21,3 17, TOTAL 178,3 140,2 110,6 89 58,
Fonte: N.B. Ayibotele. 1992. The world water: assessing the resource
Após a filtração, é realizada a desinfecção pela ação do cloro que elimina os microorganismos remanescentes do tratamento. Mantém-se um teor residual de cloro suficiente para garantir a potabilidade da água em toda a extensão da rede de distribuição.
O conhecimento do efeito de substâncias encontradas na água tem grande importância nos casos de poluição hídrica. Alguns metais, em concentrações baixas, são essenciais para o metabolismo de microorganismos, plantas, animais e do homem. Porém, absorvidos em concentrações maiores, os mesmos elementos podem ter efeitos extremamente nocivos.
As principais doenças relacionadas à ingestão de água contaminada são: cólera; disenteria amebiana; disenteria bacilar; febre tifóide e paratifóide; gastroenterite; giardise; hepatite infecciosa; leptospirose; paralisia infantil e salmonelose (Batalha e Parlatore, 1977).
A presença de ferro e manganês em águas naturais é devida às interações da água com o solo, ao passo que metais como o níquel, o zinco, o cromo, o mercúrio o cádmio, o cobre, o estanho, o chumbo, surgem de despejos industriais e atividades agrícolas (Barros, 2001).
O ferro e manganês são constituintes naturais do solo e das rochas. O ferro, um dos elementos mais abundantes, é encontrado com muito mais freqüência que o manganês. O ferro se encontra nos minerais de silicatos das rochas ígneas sob a forma de diversos óxidos, tais como a magnetita, a hematita e a limonita. Os minerais sulfurados e carbonatados também são fontes importantes de ferro, tais como a pirita e a siderita. (Di Bernardo,
O manganês encontra-se em maiores proporções nas rochas metamórficas e sedimentares e os dióxidos de manganês, tais como a manganita e a pirolusita, acumulam-se nos solos à medida que os constituintes mais solúveis se separam por lixiviação. (Benefield, et al. 1982).
O ferro é o elemento central da hemoglobina e sua função é a de transportar e estocar o oxigênio em animais considerados grandes. O transporte é feito através da hemoglobina e mioglobina, onde ocorre a respiração; o oxigênio completa o único ponto de coordenação do Fe(II) da estrutura cíclica. Na alimentação, a tendência é o uso de sais de ferro(II). Porém, na corrente sangüínea o cátion é oxidado a ferro(III) e transportado pela proteína transferrina, que inclui oxigênios fenolatos da tirosina, provocando a cor púrpura. Neste processo o ferro é estocado no corpo como FeO(OH), cuja composição pode ser vista como a mesma do ferrugem.