

















Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
propriedades coligativas
Tipologia: Notas de estudo
1 / 29

Esta página não é visível na pré-visualização
Não perca as partes importantes!






















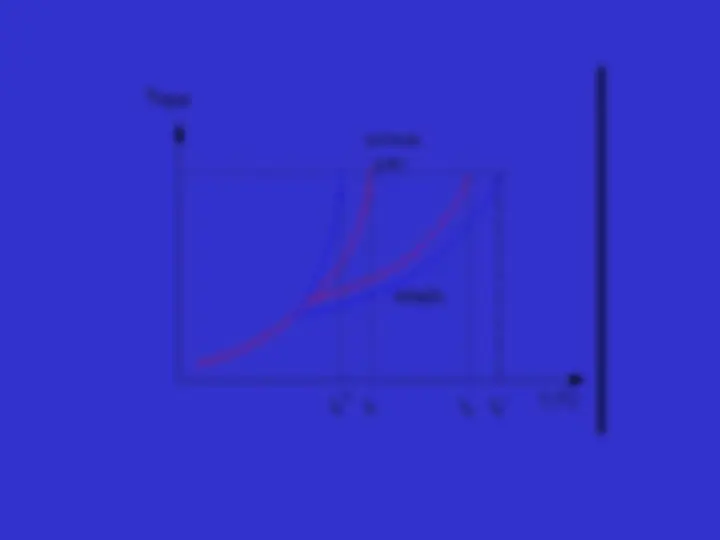
Pressão de Vapor de um Líquido
Os quatro efeitos coligativos são:
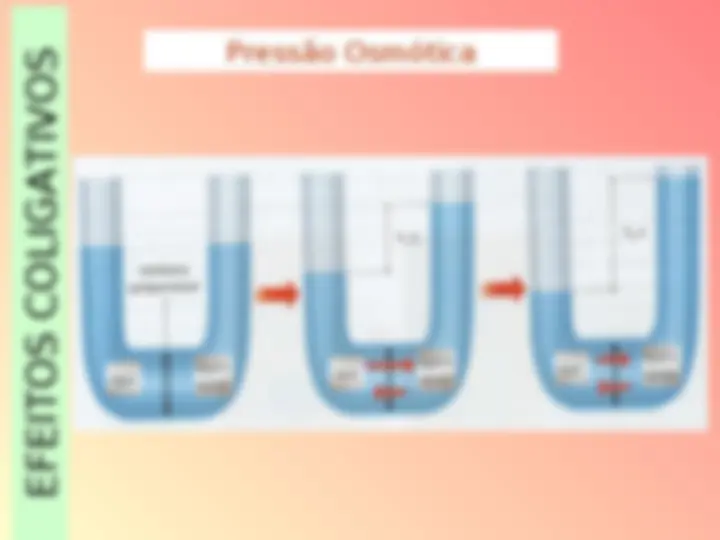
PRESSÃO OSMÓTICA : A mínima pressão exercida para impedir a osmose.
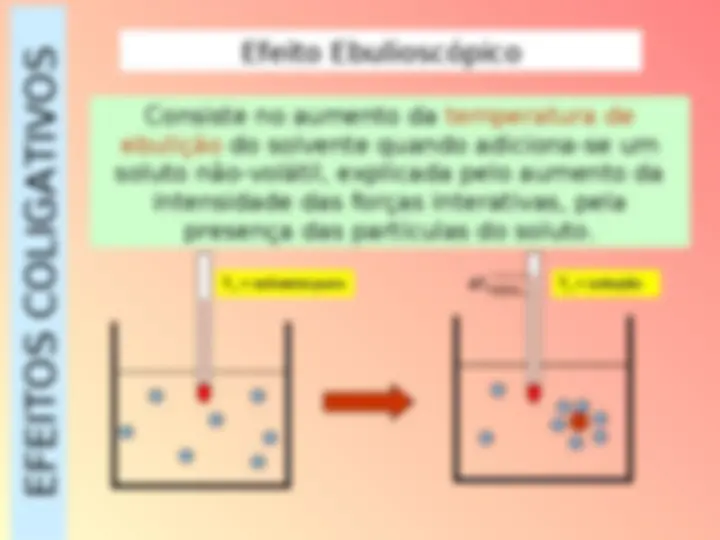
EFEITOS COLIGATIVOS Um “ efeito coligativo” é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil , a qual só depende do número de partículas (moléculas ou íons) dissolvidas e não de sua natureza! não-volátil : ponto de ebulição superior ao do solvente.
EFEITOS COLIGATIVOS
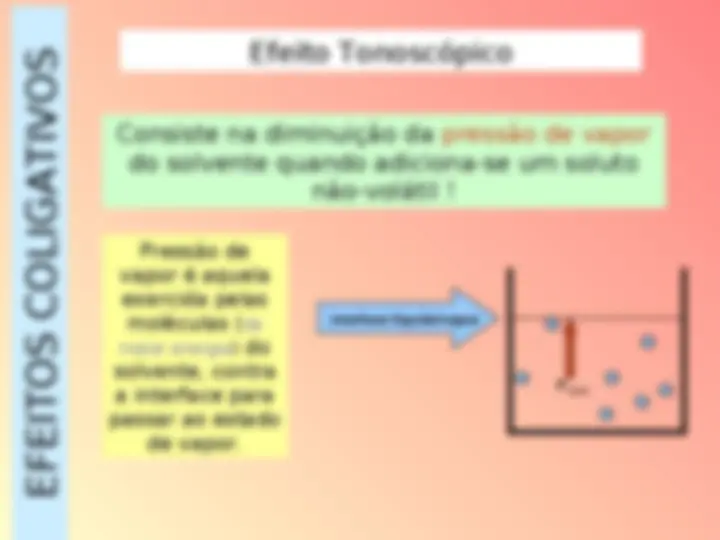
a) Pressão de vapor efeito tonoscópico
EFEITOS COLIGATIVOS Com a adição de partículas de soluto (íons ou moléculas) intensificam-se as forças atrativas moleculares e diminui a pressão de vapor do solvente. Pvapor Pvapor soluto
EFEITOS COLIGATIVOS
A pressão de vapor da solução é menor do que a do solvente puro.
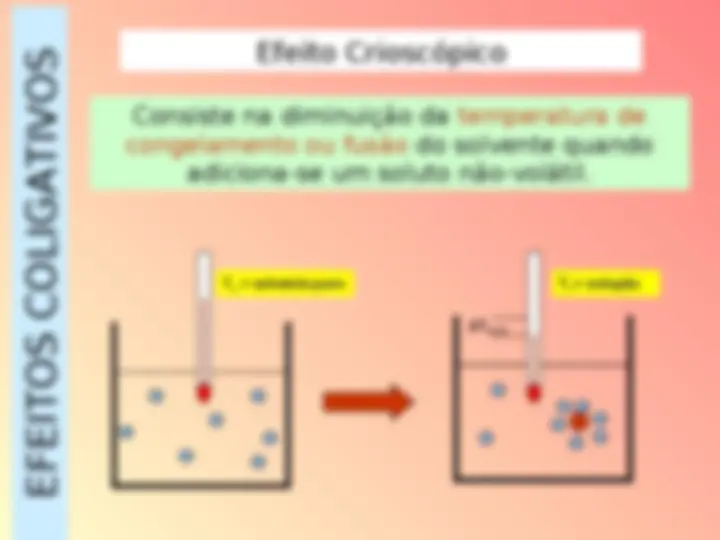
EFEITOS COLIGATIVOS Efeito Crioscópico Consiste na diminuição da temperatura de congelamento ou fusão do solvente quando adiciona-se um soluto não-volátil. To = solvente puro Tf = solução Tfusão
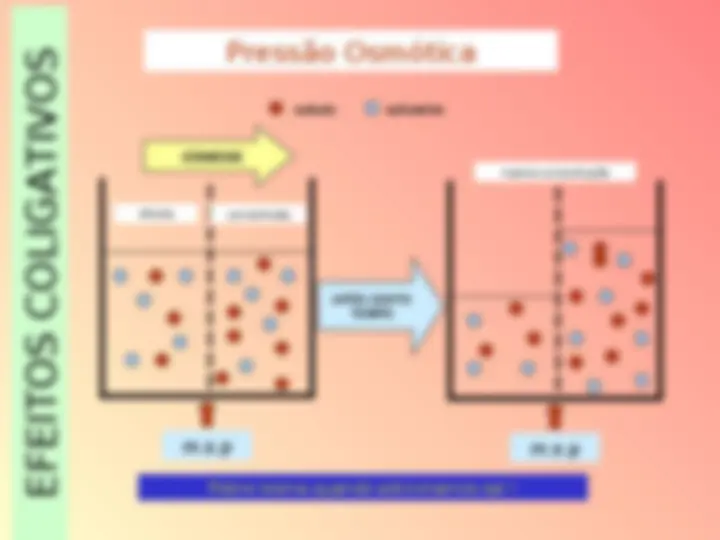
EFEITOS COLIGATIVOS Efeito Osmoscópico Consiste na variação da pressão osmótica entre duas soluções separadas entre sí por uma membrana semi-permeável (m.s.p.) ou de uma solução com o solvente puro. OBSERVAÇÕES A) Membrana semi-permeável = só permite a passagem de solvente (ex.: citoplasma, papel celofane,...); B) Osmose = passagem de solvente através de uma m.s.p., até que as soluções tornem-se isotônicas, isto é, que exerçam a mesma pressão osmótica; C) Pressão osmótica = pressão exercida pelo solvente contra a m.s.p. para que ocorra a osmose.