

















Estude fácil! Tem muito documento disponível na Docsity

Ganhe pontos ajudando outros esrudantes ou compre um plano Premium


Prepare-se para as provas
Estude fácil! Tem muito documento disponível na Docsity
Prepare-se para as provas com trabalhos de outros alunos como você, aqui na Docsity
Os melhores documentos à venda: Trabalhos de alunos formados
Prepare-se com as videoaulas e exercícios resolvidos criados a partir da grade da sua Universidade
Responda perguntas de provas passadas e avalie sua preparação.

Ganhe pontos para baixar
Ganhe pontos ajudando outros esrudantes ou compre um plano Premium
Comunidade
Peça ajuda à comunidade e tire suas dúvidas relacionadas ao estudo
Descubra as melhores universidades em seu país de acordo com os usuários da Docsity
Guias grátis
Baixe gratuitamente nossos guias de estudo, métodos para diminuir a ansiedade, dicas de TCC preparadas pelos professores da Docsity
tabela periódica - comentada
Tipologia: Notas de estudo
1 / 26

Esta página não é visível na pré-visualização
Não perca as partes importantes!



















A tabela periódica dos elementos químicos é a disposição sistemática dos elementos, em forma de tabela, em função de suas propriedades. É muito útil para ajudar a prever características e tendências dos átomos, como eletronegatividade, raio iônico, energia de ionização, possibilitando inferências químicas plausíveis.. Permite, também, prever o comportamento de átomos e das moléculas por eles formadas, ou entender por que certos átomos são extremamente reativos, enquanto outros são praticamente inertes.
1913 - Lei da Periodicidade de Moseley:
"As propriedades físicas e químicas dos elementos, são funções periódicas de seus números atômicos". Na tabela, os elementos estão arranjados horizontalmente, em seqüência numérica, de acordo com seus números atômicos, resultando o aparecimento de sete linhas horizontais (ou períodos).
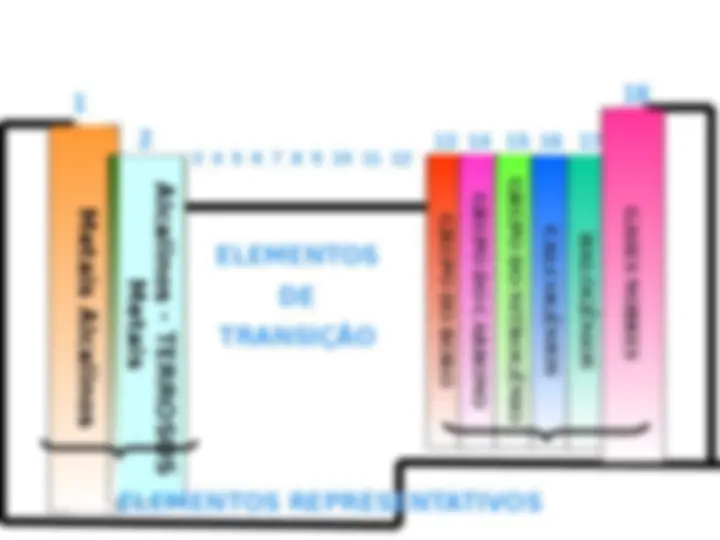
São as filas horizontais da tabela periódica. São 7 e indicam o número de níveis ou camadas preenchidas com elétrons. K L M N O P Q 1 2 3 4 5 6 7 P Q
São as colunas verticais da Tabela Periódica. Em um Grupo ou Família, encontram-se elementos com propriedades químicas semelhantes. Para os Elementos Representativos, o número do Grupo representa o número de elétrons da última camada (camada de valência). K L M N O P Q 1 2 3 4 5 6 7 1 2 3 4 5 6 7 8 9 1011 12 13 14 1516 17 18
d
O esquema abaixo mostra o subnível ocupado pelo elétron mais energético dos elementos da tabela periódica. Tabela Periódica
- Eletropositivos
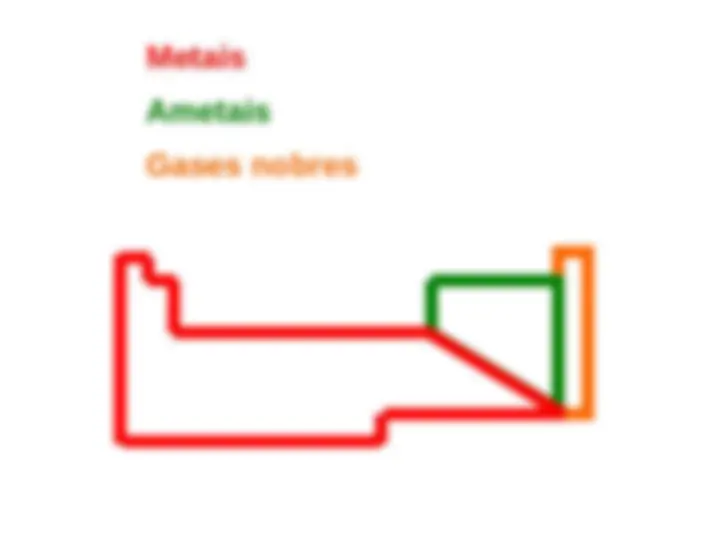
ResumoMetais Ametais Gases nobres
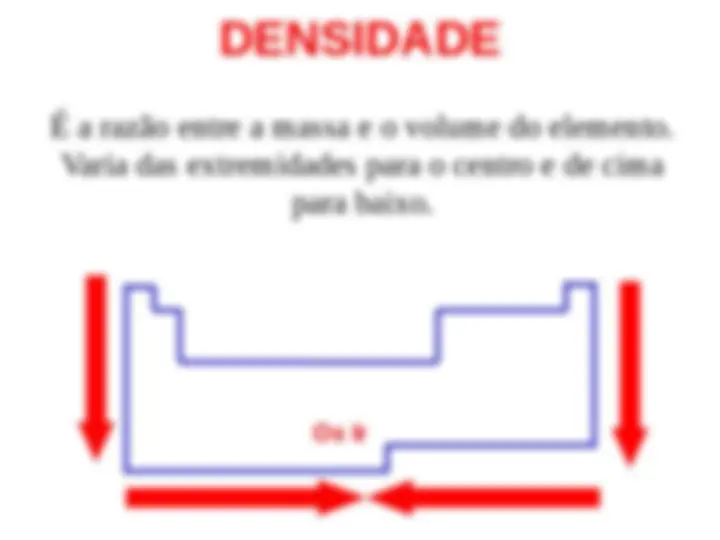
Propriedades periódicas Eletronegatividade Eletropositividade Potencial de ionização Raio atômico Eletroafinidade Densidade PROPRIEDADES PERIÓDICAS
B C N O F Cl Br I H Fr É a capacidade que um átomo tem de atrair elétrons (ametais). Varia da esquerda para a direita e de baixo para cima, excluindo-se os gases nobres. ELETRONEGATIVIDADE
He Ne Ar Kr Xe Rn H Fr É a energia necessária para arrancar um elétron de um átomo, no estado gasoso, transformando-o em um íon gasoso. Varia como a eletronegatividade e inclui os gases nobres. A segunda ionização requer maior energia que a primeira e assim sucessivamente. POTENCIAL DE IONIZAÇÃO
H He Li Na K Rb Cs Fr É a distância que vai do núcleo do átomo até o seu elétron mais externo. Inclui os gases nobres. RAIO ATÔMICO