





















Study with the several resources on Docsity

Earn points by helping other students or get them with a premium plan


Prepare for your exams
Study with the several resources on Docsity

Earn points to download
Earn points by helping other students or get them with a premium plan
Community
Ask the community for help and clear up your study doubts
Discover the best universities in your country according to Docsity users
Free resources
Download our free guides on studying techniques, anxiety management strategies, and thesis advice from Docsity tutors
Este documento proporciona una guía completa para el tratamiento de la hemorragia gastrointestinal, incluyendo información sobre la estabilización del paciente, el diagnóstico, el tratamiento endoscópico, el tratamiento farmacológico y la cirugía. Se abordan diferentes tipos de hemorragia gastrointestinal, como la hemorragia por úlcera péptica, la hemorragia por varices esofágicas y la hemorragia digestiva baja. El documento también incluye información sobre la prevención de la hemorragia gastrointestinal y el manejo de los pacientes de alto riesgo.
Typology: Study Guides, Projects, Research
1 / 31

This page cannot be seen from the preview
Don't miss anything!
























La hemorragia digestiva alta (HDA) es la pérdida sanguínea pro- vocada por una lesión situado en el tracto gastrointestinal, en un punto localizado por encima del ángulo de Treitz. Representa una de las condiciones clínicas más prevalentes en los Servicios de Urgencia hospitalaria y de Gastroenterología, con una inci- dencia que varía, según el área estudiada, entre 48 y 160 casos por 100.000 habitantes y año. Las lesiones de origen péptico son su causa más frecuente.
En los últimos años se ha modificado el patrón epidemiológico de la hemorragia gastrointestinal. Así, en nuestro medio se ha constatado un discreto descenso de la incidencia de HDA y un aumento de la incidencia de hemorragia digestiva baja (HDB). La hemorragia de origen varicosa no es de las más frecuentes, pero sus tasas de morbilidad y mortalidad son particularmente eleva- das. Tomando en cuenta estas consideraciones dividiremos este capítulo en tres apartados principales que harán referencia a la HDA de origen péptico, a la HDA varicosa y a la HDB.
Todos los hospitales que atienden a pacientes de estas caracte- rísticas deben disponer de protocolos que permitan un abordaje multidisciplinar de este problema, incluyendo la disponibilidad de un endoscopista con experiencia en técnicas de hemostasia y el apoyo de personal de enfermería entrenado.
Barkun AN, Bardou M, Kuipers EJ, Sung J, Hunt RH, Martel M, Sin- clair P. International consensus recommendations on the mana- gement of patients with nonvariceal upper gastrointestinal blee- ding. Ann Intern Med. 2010;152:101-13.
3.1. Presentación clínica
La HDA se manifiesta habitualmente en forma de hematemesis o deposiciones melénicas. Se denomina hematemesis al vómito de sangre fresca, coágulos sanguíneos o restos hemáticos oscuros (“poso de café”) y melena a la emisión de heces de color negro in- tenso y brillante, blandas y muy malolientes. La melena requiere de una extravasación de al menos 60-100 ml de sangre en el tubo di- gestivo alto. La hematoquecia es la exteriorización, a través del ano, de sangre roja fresca o de color rojo oscuro. El color de las heces no siempre es un indicador fiable del origen de la hemorragia. Así, la melena puede aparecer en hemorragias procedentes del intestino delgado o del colon derecho, especialmente si existe un tránsito lento. A su vez, la hematoquecia puede verse en hemorragias di- gestivas altas masivas (al menos 1000 ml), generalmente asociadas a un tránsito rápido o a la presencia de una hemicolectomía de- recha. En una serie de pacientes con hematoquecia grave, el 74% tenía lesiones cólicas (angiodisplasias, divertículos y neoplasias), el 11% lesiones gastroduodenales y un 9% lesiones en el intestino delgado. En un 6% no logró demostrarse la lesión responsable del sangrado. Con frecuencia variable, dependiendo de la cantidad de sangre extravasada, estos hallazgos se acompañan de los propios de la hipovolemia y de la anemia aguda posthemorrágica, como palidez, taquicardia, sudor frío e hipotensión. Tampoco es excep- cional que un paciente con HDA grave se presente con una clínica de síncope, angor o disnea, antes de producirse la exteriorización hemorrágica. Esta forma de presentación traduce la existencia de un fallo de oxigenación cerebral, miocárdica o de insuficiencia res- piratoria, que, por sí solas, son indicativas de gravedad. Tal situación debe sospecharse en cualquier paciente que presenta, además de
Hemorragia gastrointestinal
Cándido Villanueva Sánchez* Juan Carlos García Pagán** Antonio José Hervás Molina***
* (^) Servicio de Aparato Digestivo. Hospital de la Santa Creu i Sant Pau. Barcelona ** (^) Servicio de Hemodinámica Hepática. Hospital Clínic. Barcelona CIBERehd (Centro de Investigación Biomédica en Red de Enfermedades Hepáticas y Digestivas) *** (^) Sección de Aparato Digestivo. Hospital Universitario Reina Sofía. Córdoba
los signos mencionados, los típicos de una anemia aguda posthe- morrágica. La ingesta previa o reciente de AINE aumenta la proba- bilidad de que estos síntomas sean debidos a una HDA todavía no exteriorizada.
3.2. Evaluación inicial
Ante un paciente con sospecha de hemorragia digestiva debe llevarse a cabo un examen inicial con historia, un examen físico y una evaluación analítica elemental que permitan asegurar el cumplimiento de tres principios básicos: 1) confirmar la presen- cia de la hemorragia, 2) evaluar la magnitud del sangrado y 3) comprobar si la hemorragia persiste activa. A continuación se desglosan algunas consideraciones básicas:
anamnesis y la exploración física deben descartar que se trate de deposiciones falsamente melénicas. Ciertas substancias al- teran el color de las heces y pueden simular melenas. Así ocurre con la ingesta de determinados alimentos (morcilla, calamares en su tinta, etc.) o fármacos (sales de hierro, bismuto, regaliz, etc.). En caso de duda, puede ser útil la búsqueda de evidencias más consistentes, como la presencia de sangre en el aspirado por sonda nasogástrica (SNG), el propio tacto rectal o la elevación de los niveles de urea plasmática, un hallazgo frecuentemen- te observado en la HDA. Si bien la presencia de sangre roja o “poso de café” en el aspirado por SNG, asegura el origen alto de la hemorragia, la presencia de un aspirado claro no excluye totalmente esta posibilidad. De hecho, entre un 15% y un 20% de los pacientes con HDA bien documentada por endoscopia presentan un aspirado limpio por SNG.
3.3. Evaluación hemodinámica
y reposición de la volemia
El tratamiento de la hemorragia digestiva incluye medidas de tipo genérico, sea cual sea su origen, dirigidas a estabilizar la situación hemodinámica y otras medidas específicas que dependerán de la
Trastornos de la coagulación
En caso de hemorragia grave es aconsejable corregir cualquier deterioro de la hemostasia susceptible de tratamiento. En caso de politransfusión (6 o más concentrados en 24h), hay que valorar la transfusión de plasma fresco, adecuando su indicación a las prue- bas de coagulación. En pacientes anticoagulados, por encima del
rango terapéutico e incluso dentro de dicho rango, se debe admi- nistrar 10 mg de Vit K i.v. En estos pacientes, en caso de hemorra- gia masiva, debe considerarse la utilización de crioprecipitados. La anticoagulación puede reiniciarse tan pronto como se controle la hemorragia, dependiendo del balance riesgo/beneficio. Hasta su reinicio puede ser útil el empleo de heparina a dosis profilácticas.
Monitorización
Villanueva C, Colomo A, Bosch A, et al. Transfusion Strategies for Acute Upper Gastrointestinal Bleeding. N Engl J Med 2013. 368:11-21.
3.4. Hemorragia
por úlcera péptica
La mortalidad de la HDA de origen péptico se ha reducido signi- ficativamente en las últimas décadas, lo que resulta atribuible a distintos factores como los avances introducidos en la terapéu- tica endoscópica, la aparición de antisecretores cada vez más potentes o el conocimiento del papel del Helicobacter pylori en
Hemorragia gastrointestinal 3
la fisiopatología de la enfermedad ulcerosa. Sin embargo, esta mortalidad sigue siendo considerable y se sitúa todavía entre el 5% y 10%, siendo la edad y comorbilidad de los pacientes los principales determinantes en el momento actual. La edad de los pacientes con HDA es cada vez más avanzada, lo que cabe rela- cionarla con el envejecimiento progresivo de la población en los países desarrollados. En este grupo de edad es más prevalente la coexistencia de enfermedades asociadas graves y un mayor consumo de fármacos potencialmente lesivos para la mucosa gastrointestinal, como el ácido acetilsalicílico (AAS) y otros antiin- flamatorios no esteroideos (los AINE).
Información relevante en la historia clínica
Tratamiento hemostático de elección. Endoscopia urgente diagnóstica y terapéutica
Parámetro Puntuación Edad < 60 años 0 60-79 años 1 ≥ 80 años 2 Hemodinámica Sin shock (PAS > 100; FC < 100) 0 Taquicardia (PAS > 100; FC >100) 1 Hipotensión (PAS < 100) 2 Comorbilidad Sin enfermedades asociadas 0 Enfermedades asociadas graves 2 Insuficiencia renal, cirrosis, neoplasias 3 Endoscopia Sin lesiones ni signos de HR o M-W 0 Resto de lesiones 1 Neoplasias 2
Sin signos de hemorragia (Forrest IIc o III) 0 Sangre fresca (o resto de Forrest) 2 Riesgo según el total de puntos Riesgo bajo ≤ 2 puntos Riesgo intermedio 3-4 puntos Riesgo alto ≥ 5 puntos PAS = presión arterial sistólica; HR = hemorragia reciente; M-W = Mallory-Weiss Tabla 3.2. Índice de Rockall para evaluar el pronóstico de la HDA
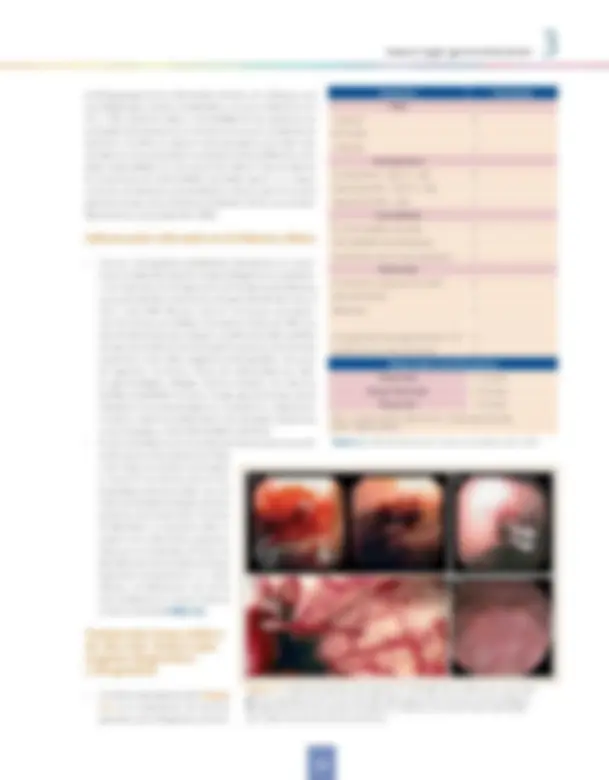
Figura 3.1. Endoscopia digestiva alta urgente en la HDA. A. Úlcera péptica con vaso visible. B. Clips colocados sobre el vaso visible. C. Hemorragia activa en jet por varices esofágicas. D. Gastropatía leve, con mucosa con patrón “en mosaico“, con zonas lineales más pálidas que rodean mucosa de aspecto hiperémico
Hemorragia gastrointestinal 3
presencia de sangrado activo o de estigmas de hemorragia re- ciente, signos que constituyen un indicador preciso del riesgo de recidiva hemorrágica, lo que a su vez permite seleccionar a los pacientes candidatos a la terapéutica endoscópica. Una lesión con sangrado activo tiene un riesgo de persistencia he- morrágica o de recidiva superior al 80%. Cuando se visualiza un vaso visible no sangrante el riesgo es del 50%. Se define como vaso visible la presencia de una elevación, con aspecto de pezón, de distintos colores (roja, granate, oscura o incluso blanca) en el fondo de la lesión. La probabilidad de recidiva disminuye al 20-30% si se observa un coágulo adherido, a un 5-10% cuando sólo hay manchas planas de hematina (signos indirectos,) y a un 1-2% cuando el fondo de la lesión es limpio. La clasificación de Forrest, basada en estos parámetros, ha per- mitido sistematizar los estigmas de hemorragia (Tabla 3.3).
Grado de Forrest Descripción^
% de recidivas Ia Sangrado activo arterial en jet o chorro 90% Ib Sangrado rezumante o “en sábana” 60-80% IIa Vaso visible en el lecho de la lesión 50% IIb Coágulo fresco adherido 25-30% IIc Manchas hematínicas (oscuras) 7-10%
III Lesión con base limpia, cubierta porfibrina 3-5%
Tabla 3.3. Parámetros clínicos que permiten evaluar la magnitud de la pérdida hemática
Técnicas de tratamiento endoscópico
En la actualidad se dispone de distintas técnicas de hemostasia endoscópica, que incluyen básicamente técnicas de inyección (adrenalina, esclerosantes, pegamentos), procedimientos térmi- cos de contacto (electro-coagulación mono o bipolar, termo- coagulación) o no (láser, gas argón) y procedimientos mecánicos (hemoclips, ligadura con bandas).
El principal mecanismo por el que actúan los distintos métodos de tratamiento endoscópico consiste en el efecto ocasionado sobre los tejidos (químico, térmico o mecánico) que acabará originando la formación de un trombo que ocluye el punto sangrante de la pared vascular (Figura 3.2). También la induc- ción de vasoconstricción (principalmente con la inyección de adrenalina) y el edema que comprime el vaso sangrante con- tribuyen a obtener la hemostasia. Para evitar complicaciones, es importante que el efecto del tratamiento quede confinado selectivamente a su lugar de acción y que no afecte a otras capas de la pared intestinal. En modelos experimentales de úl- cera sangrante, los métodos térmicos han resultado más efec- tivos que la inyección para conseguir la hemostasia, mientras que entre los métodos térmicos los de contacto han resultado más efectivos. En estos modelos, incluso los métodos térmicos han resultado escasamente efectivos para conseguir hemos- tasia en los vasos de mayor calibre (de más de 2 mm). Sólo de- terminados métodos mecánicos, no disponibles en la práctica clínica rutinaria, parecen efectivos en vasos de gran calibre. Sin embargo, los modelos de úlcera experimental no se ade- cuan a la úlcera péptica de los humanos. Es probable que el prolongado efecto compresivo, conseguido con la inyección, mediante la acción física del volumen depositado en un espa- cio poco expandible, como el fondo fibrótico de una úlcera péptica, no se reproduzca en los modelos experimentales, con escaso componente fibrótico. De hecho, en múltiples es- tudios clínicos comparativos no se han observado diferencias significativas entre los distintos tratamientos endoscópicos. En la práctica clínica, los métodos de inyección son los más ampliamente disponibles, posiblemente debido a que cons- tituyen la opción más simple, barata y fácil de ejecutar. Pro- bablemente, los métodos térmicos más empleados son la sonda de calor (heater probe) y la electrocoagulación bipolar o
multipolar. Con los dispositivos de electrocoagulación bipolar, el electrodo positivo y el negativo que completan el circuito están muy cerca entre sí (en la punta de la sonda) lo que pro- duce un flujo puntual de corriente entre ambos. Como conse- cuencia de ello, tienen menor riesgo de inducir quemaduras profundas que la coagulación unipolar, y por lo tanto menor riesgo de perforación, además de otras ventajas como la de permitir la compresión mecánica previa y la aplicación tan- gencial de la sonda. Los dispositivos de electrocoagulación multipolar tienen tres pares de electrodos en la punta de la sonda, y cualquiera de ellos puede completar el circuito al contactar con el tejido, lo que facilita su empleo. En algunos
modelos de electrocoagulación multipolar los electrodos se alternan en una disposición espiral en la punta de la sonda, lo que facilita su aplicación tangencial.
Tanto los estudios controlados como su metaanálisis han cons- tatado la eficacia de la inyección endoscópica en el control de la hemorragia por úlcera. Otros parámetros, como los requerimien- tos transfusionales, la necesidad de cirugía urgente y la duración de la estancia hospitalaria, también mejoran significativamente, mientras que el metaanálisis ha demostrado que también me-
Figura 3.2. Representación esquemática de los mecanismos de acción del tratamiento endoscópico de la hemorragia por úlcera péptica (1) que consigue la hemostasia mediante la obliteración del vaso sangrante (2), empleando métodos de inyección (3) o métodos térmicos de contacto (4 y 5), así como métodos a distancia (6)
activo en el momento de la endoscopia y la presencia de úlceras de gran tamaño (>2 cm). Las úlceras localizadas en la porción alta de la curvadura menor del estómago o en la cara posterior del bulbo también presentan mayor riesgo de recidiva. No se ha determinado si alguna medida terapéutica puede prevenir el fra- caso en estos grupos de alto riesgo.
En caso de fracaso del tratamiento endoscópico, es recomendable un segundo intento de terapéutica endoscópica, antes de plan- tear la cirugía. Esta actitud se sustenta en los resultados de un estu- dio prospectivo y aleatorizado, que evaluó de forma comparativa los resultados de la terapéutica endoscópica con los de la cirugía en un grupo de pacientes con signos de recidiva hemorrágica. La endoscopia se asoció a una menor tasa de complicaciones que la cirugía, sin incrementar el riesgo de mortalidad.
Angiografia
En aquellos pacientes con hemorragia persistente o recidivante, puede realizarse una arteriografía selectiva del tronco celíaco y ar- teria mesentérica superior. Esta exploración permite diagnosticar hemorragias arteriales o capilares si existe un extravasado sanguí- neo mínimo de 0,5 ml/min, aunque no suele detectar sangrados venosos. La embolización arterial percutánea puede ser una alter- nativa a la cirugía cuando fracasa la terapia endoscópica, especial- mente en pacientes de alto riesgo quirúrgico y/o en los centros que cuentan con un servicio de radiología vascular intervencio- nista experimentado. Para la embolización de lesiones sangrantes, se han utilizado esponjas de gelatina, alcohol polivinílico, pega- mentos cianoacrílicos o ”coils”. La angiografía también puede ser útil para diagnosticar lesiones que pueden pasar desapercibidas a la endoscopia, como tumores submucosos o lesiones vasculares.
Se debe plantear la cirugía urgente en caso de recidiva tras un segundo tratamiento, o en caso de recidiva masiva tras un primer tratamiento endoscópico, o como tratamiento inicial en hemorra- gias masivas en las que no se consigue la estabilidad hemodiná- mica inicial con reposición intensiva de la volemia. En el contexto de la emergencia, la cirugía de elección suele ser la sutura de la lesión sangrante asociada a una vagotomía y piloroplastia. Como ya se ha comentado, la angiografía terapéutica constituye una al- ternativa a la cirugía, particularmente cuando la condición clínica del enfermo es muy precaria y el riesgo quirúrgico es prohibitivo.
Tratamiento médico de la HDA péptica
La inhibición de la secreción ácida gástrica favorece la cicatriza- ción de las lesiones mucosas y además favorece la agregación plaquetaria y la formación y estabilización del coágulo. Se estima
que para optimizar la hemostasia se debe mantener un pH intra- gástrico > 4 (o mejor > 6) de forma sostenida, lo que consiguen con mayor eficacia dosis altas de IBP, en infusión continua capaz de evitar fluctuaciones.
En la actualidad, dada la eficacia probada de los IBP y el beneficio marginal de los antagonistas-H2, no se recomienda la utilización de estos últimos en la HDA. En pacientes con estigmas endoscó- picos de alto riesgo, la terapia endoscópica debe asociarse a la administración inicial de un bolus de IBP e infusión endovenosa con dosis altas (8 mg/h) que se suele mantener durante las pri- meras 72 horas ya que éste es el periodo de máximo riesgo de recidiva. En comparación con el tratamiento con anti-H2 o place- bo, el tratamiento con IBP reduce en estos pacientes la incidencia de recidiva y la necesidad de cirugía y, según indica el metaa- nálisis de los ensayos aleatorizados con más de 5.000 pacientes, también reduce la mortalidad en pacientes con vaso visible no sangrante o hemorragia activa. Está por establecer si las dosis usuales de IBP i.v., o dosis altas de IBP oral también podrían ser efectivas. Su empleo puede considerarse cuando no se dispone de tratamiento con dosis altas intravenosas. Tras las primeras 72 horas, dado el menor riesgo de sangrado, se puede seguir el tra- tamiento oral con IBP hasta la cicatrización de la úlcera, para lo que puede ser suficiente una dosis estándar.
Tras un episodio de HDA, los pacientes deben ser dados de alta hospitalaria con tratamiento de IBP por vía oral por un tiempo apropiado a su patología de base. Aunque la administración de IBP a dosis estándar es suficiente para la curación de la mucosa de las úlceras pépticas, es frecuente en nuestro medio utilizar dosis dobles durante el periodo de cicatrización tras una HDA por úlcera péptica. No hay evidencia que soporte esta medida, si bien tanto los costes como los riesgos asociados son mínimos. La duración y, en ocasiones, la dosis del tratamiento deben adaptarse a la patolo- gía del paciente, recomendándose cuatro semanas para la úlcera duodenal y ocho para la úlcera gástrica. Además, los pacientes que estén en tratamiento con AAS o AINE pueden necesitar un trata- miento profiláctico con un IBP por un tiempo más prolongado.
Se ha sugerido que el tratamiento con somatostatina u octreóti- do puede reducir el riesgo de resangrado observado con antago- nistas-H2 o placebo, aunque no se ha demostrado que mejore la eficacia de los IBP solos o asociados a tratamiento endoscópico, por lo que no deben administrarse de manera rutinaria en la he- morragia por úlcera péptica.
La mayoría de los pacientes (cerca de las 2/3 partes) presentan ane- mia ferropénica tras un episodio de HDA, por lo que es aconsejable cursar un estudio del metabolismo férrico antes del alta y adminis-
Hemorragia gastrointestinal 3
trar suplementos de hierro, en caso de que se requieran, por vía oral o endovenosa si existe anemia grave y/o según comorbilidad.
Tratamiento quirúrgico
Como se ha comentado, la cirugía está indicada cuando la he- morragia no se logra controlar con las medidas terapéuticas far- macológicas y endoscópicas habituales, en pacientes con HDA masiva o exanguinante o en aquellos con HDA persistente o reci- divante tras un segundo tratamiento endoscópico.
Si se sospecha que la hemorragia está causada por una fístula aortoentérica (enfermo portador de injerto aórtico, aneurisma aórtico, cuerpos extraños enclavados en esófago, etc.) debe reali- zarse una endoscopia urgente y/o un angio-TC. Si se comprueba esta lesión, debe realizarse cirugía urgente, ya que la hemorragia inicial autolimitada suele ir seguida, a las pocas horas, por una hemorragia masiva generalmente mortal.
Prevención de la recidiva a largo plazo
preceptivo realizar un control endoscópico en torno a las ocho semanas para confirmar la cicatrización y asegurar, me- diante estudio histológico, el carácter péptico y benigno de la lesión.
Hemorragia gastrointestinal 3
3.5. Hemorragia
por hipertensión portal
La HDA por hipertensión portal puede ser secundaria a rotura de varices esofagogástricas, varices ectópicas y/o gastropatía de la hipertensión portal.
Las varices esofágicas están presentes en un 50% de los pacien- tes con cirrosis en el momento del diagnóstico. En pacientes sin varices, la incidencia anual de desarrollo es del 6%. La he- morragia digestiva por varices esofágicas (Figura 3.1) es una
de las complicaciones más frecuentes y graves de la cirrosis hepática, que además puede actuar como desencadenante de otras complicaciones como infecciones bacterianas y síndrome hepatorrenal.
Bosch J, Abraldes JG, Albillos A, et al. Hipertensión Portal: recomen- daciones para su evaluación y tratamiento: documento de consen- so esponsorizado por la Asociación Española para el Estudio del Hígado (AEEH) y el Centro de Investigación Biomédica en Red de enfermedades Hepáticas y Digestivas (CIBERehd). Gastroenterol Hepatol 2012; 35: 421-50.
Fisiopatología
Para que se desarrollen varices, el aumento en el gradiente de presión portal (GPP) debe superar el valor umbral de 10 mmHg (por ello a este valor se le ha denominado hipertensión portal clínicamente significativa). Una vez formadas, se estima que las varices pequeñas (definidas como aquellas menores de 5 mm de diámetro) aumentan de tamaño a grandes (mayores de 5 mm) a un ritmo de un 12% anual (Tabla 3.4). La rotura de la variz se producirá cuando la tensión que supera la pared de la misma supera un punto crítico o punto de rotura. De acuerdo con la ley de Laplace, la tensión de la pared de las varices se puede expresar por la ecuación:
Tensión pared variz
Gradiente de presión entre el interior de la variz y la presión intraluminal esofágica o gradiente transmural de la variz
x radio
Grosor de la pared
Varices esofágicas Clasificación en 2 categorías (Baveno II): · Pequeñas (< 5 mm) · Grandes (> 5 mm) Varices gástricas (clasiicación de Sarin)
Varices esofagogástricas tipo 1: prolongación subcardial de las varices esofágicas por la curvatura menor gástrica
Varices esofagogástricas tipo 2: prolongación subcardial de las varices esofágicas por la curvatura mayor hacia fundus
Varices gástricas aisladas tipo 1: variz gástrica sin conexión con varices esofágicas (aisladas) situadas en el fundus
Varices gástricas aisladas tipo 2: variz gástrica localizada en cualquier otra localización del estómago diferente del fundus y sin conexión con las varices esofágicas Tabla 3.4. Clasificación de las varices esofagogástricas
BOX 1.
TRATAMIENTO DE LA HEMORRAGIA DIGESTIVA NO VARICOSA
· La reposición de la volemia debe ajustarse a las siguientes recomendaciones: Disponer de un buen acceso venoso con al menos 2 cánulas i.v. cortas y de grueso calibre (16G o 14G) para una rápida infusión de líquidos. La volemia se debe reponer con cristaloides o coloides a un ritmo adecuado para evitar la hipoperfusión. Una reposición excesiva de la volemia podría favorecer la recidiva hemorrágica. No es necesaria la transfusión de UCH para reponer la volemia.
· La transfusión de UCH se debe indicar cuando la Hb desciende por debajo de 7 g/dl, con el objetivo de mantenerla alrededor de 8 g/dl (Hto sobre 24%). Dependiendo de factores como la comorbilidad, se puede indicar la transfusión de UCH con Hb < 8 g/dl. · La endoscopia urgente es imprescindible para el diagnóstico de la lesión sangrante, para identificar los estigmas de hemorragia y para posibilitar el tratamiento endoscópico.
TRATAMIENTO DE LA HEMORRAGIA POR ÚLCERA PÉPTICA
· El tratamiento endoscópico está indicado en caso de hemorragia activa o de vaso visible no sangrante. Se intentará desprender el coágulo adherido e identificar el signo subyacente. El tratamiento hemostático no está indicado en pacientes con lesiones sin estigmas o con presencia de manchas planas de hematina. · La monoterapia con inyección de adrenalina consigue resultados subóptimos y debe asociarse a un segundo método hemostático endoscópico, como la inyección de un agente esclerosante, un método térmico o la implantación de clips. La revisión endoscópica electiva sistemática no es útil. · La terapia endoscópica debe asociarse con IBP en infusión endovenosa continua con objeto de reducir el riesgo de recidiva hemorrágica y la mortalidad. · Cuando fracasa el tratamiento inicial se puede intentar un segundo tratamiento endoscópico. Si éste fracasa debe indicarse cirugía. La embolización arterial percutánea es una alternativa a la cirugía en pacientes de alto riesgo quirúrgico.
La presión intravariceal depende del GPP. Múltiples estudios han demostrado que el GPP debe superar un valor dintel de 12 mmHg para que se produzca la ruptura de la pared de la variz. Esta ecuación también permite deducir que la dilatación de las varices (aumento del radio/tamaño de la variz) y el adel- gazamiento de su pared (aparición de signos rojos) aumentan la tensión de la pared variceal facilitando su ruptura. Por ello, el riesgo de hemorragia es mucho mayor en pacientes con varices grandes y/o con signos rojos y mucho menor en pacientes con varices pequeñas y sin signos rojos.
Manifestaciones clínicas y diagnóstico
tabilidad hemodinámica y/o hematemesis franca se reco- mienda acortar este intervalo a 6 h.
Tratamiento del episodio hemorrágico agudo
Figura 3.4. Tratamiento sugerido en el manejo de hemorragia digestiva por varices esofágicas
!! RECUERDA. El tratamiento endoscópico de elección en las varices esofágicas es la ligadura endoscópica. La escleroterapia sólo debería utilizarse en casos excepcionales en los que la ligadura no sea factible.
Las complicaciones más frecuentes de las técnicas en- doscópicas son úlceras esofágicas, que pueden causar hemorragias y perforación del esófago, estenosis esofá- gica, sepsis y complicaciones respiratorias. La mortalidad de la técnica, en el tratamiento urgente de la hemorragia, alcanza el 5%.
aproximadamente en la mitad de los casos se produce una recidiva al desinflar el balón. Además el procedimien- to presenta numerosas complicaciones graves asociadas (en más del 25% de los casos), entre las que destacan la neumonía por aspiración y la rotura esofágica. Por ello, el taponamiento esofágico debe emplearse sólo como me- dida temporal, no más de 24 horas, y debe ser llevado a cabo por personal experto y en condiciones que permitan una estricta vigilancia (UCI o unidad de sangrantes).
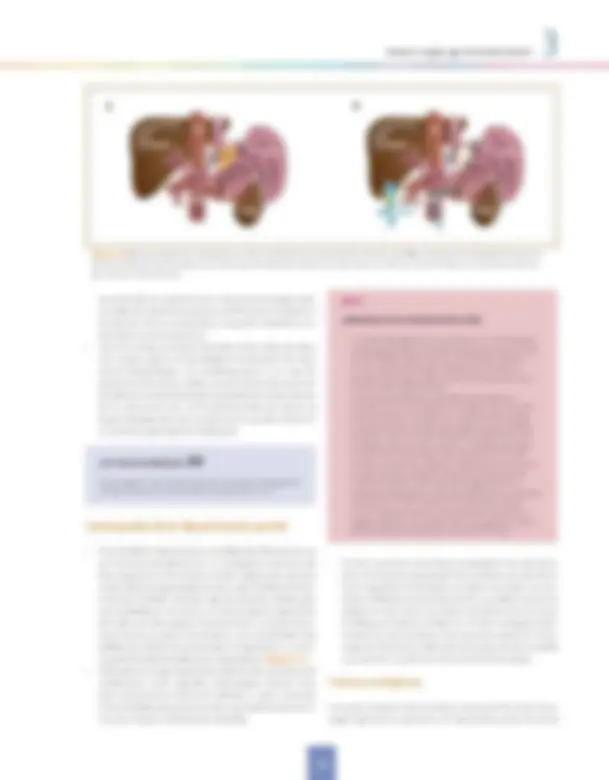
Figura 3.5. TIPS, o derivación portosistémica percutánea intrahepática (DPPI)
Recientemente se ha propuesto la utilización de próte- sis esofágicas metálicas autoexpandibles como alter- nativa al balón de Sengstaken. Datos preliminares de un estudio aleatorizado sugieren que estas prótesis tendrían una eficacia similar pero menos efectos adversos que el balón. Si estos datos se confirman convertirían esta técni- ca en la alternativa de elección en esta situación. Derivaciones portosistémicas. DPPI: La derivación por- tosistémica percutánea intrahepática (DPPI), más conoci- da como TIPS (Figura 3.5), acrónimo de las iniciales de su denominación anglosajona (transjugular intrahepatic portosystemic shunt), ha sustituido prácticamente a la ci- rugía derivativa, tanto en situaciones de urgencia como electivas. La DPPI consiste en la creación de una deriva- ción portosistémica intrahepática de diámetro prefijado («calibrada») por métodos de radiología intervencionista. El procedimiento per se entraña una serie de riesgos: he- moperitoneo, hemobilia, lesiones vasculares, lo que exi- ge que sea realizada por personal altamente cualificado en centros de referencia, que permitan, realizar un míni- mo de exploraciones anuales que probablemente nunca debería ser inferior a 5-10 procedimientos.
Hemorragia gastrointestinal 3
La principal limitación anterior de la DPPI, la disfunción por estenosis progresiva del tracto parenquimatoso o de la vena suprahepática por proliferación de neoíntima, que obligaba a un estrecho seguimiento e intervencio- nismo, se ha reducido de manera drástica con el uso de prótesis recubiertas con PTFE (politetrafluoretileno), que son las de elección en la actualidad. Si bien con la uti- lización de las nuevas prótesis recubiertas el riesgo de desarrollar encefalopatía hepática también ha disminui- do, éste sigue siendo un problema relevante ya que ésta puede aparecer hasta en un 30% de los pacientes, y en un 5% es lo bastante grave como para requerir reducción e incluso oclusión de la DPPI. El riesgo es especialmente importante en pacientes mayores de 65 años, con ante- cedentes de encefalopatía y con el uso de DPPI de mayor diámetro (> 10 mm) o descensos muy importantes del GPP post-DPPI (inferior a 5-6 mmHg). La DPPI, como tratamiento de rescate en el episodio agu- do hemorrágico, logra controlar la hemorragia en más del 90% de los pacientes. No obstante, a pesar de ello, la mortalidad en este escenario es muy elevada (superior al 50%) debido a que los pacientes en quienes ha fracasado el tratamiento médico/endoscópico inicial se hallan en una situación en la que son frecuentes las complicacio- nes sépticas, con deterioro adicional de su función hepá- tica o con fallo multiorgánico.
tes de alto riesgo. Es posible que el MELD sea uno de estos parámetros.
!! RECUERDA. Los pacientes de alto riesgo de fracaso terapéutico deberían ser remitidos a centros especializados donde pudiera im- plantarse una DPPI en las primeras 24-72 horas desde el inicio de la hemorragia.
García-Pagán JC, Caca K, Bureau C, et al. Early TIPS (Transjugular Intrahepatic Portosystemic Shunt) Cooperative Study Group. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 24; 362 (25):2370-9.
Profilaxis primaria de la hemorragia por varices
El objetivo de este tratamiento es prevenir la aparición de la pri- mera hemorragia por rotura de varices en pacientes que nunca han sangrado.
El riesgo de presentar hemorragia variceal es mayor en pacientes con varices de gran tamaño (> 5 mm), presencia de signos ro- jos en la pared y mala función hepatocelular. A efectos prácticos, todos los pacientes con varices son susceptibles de recibir trata- miento profiláctico, excepto pacientes Child-Pugh A con varices pequeñas (Grado I) y sin signos rojos.
Hemorragia gastrointestinal 3
destacar que si el gradiente de presión portal es inferior a 10 mmHg, el paciente no desarrollará varices hasta que el GPP supere este valor dintel. No existe en la actualidad ningún tra- tamiento capaz de prevenir la formación de varices.
En pacientes con varices pequeñas, el riesgo de desarrollar varices voluminosas es del 25% a los 2 años. El tratamiento betabloqueante puede disminuir el riesgo de progresión, por lo que puede iniciarse en esta fase si no existen contraindicaciones, aunque ésta no es una indicación establecida. Si no se inicia tratamiento, es prudente efectuar endoscopias de seguimiento con intervalos más cortos. Por lo general, los enfermos aceptan bien un control anual; en es- pecial, si se realiza con sedación (aceptabilidad próxima al 100%).
Prevención de la recidiva hemorrágica
El tratamiento de elección en la prevención de la recidiva hemo- rrágica es el empleo combinado de betabloqueantes no cardio- selectivos y la ligadura endoscópica con bandas elásticas de las varices. Este tratamiento ha mostrado ser más eficaz que cual- quiera de los dos administrados de forma aislada (Figura 3.4). La asociación de 5-mononitrato de isosorbida al tratamiento be- tabloqueante potencia la reducción de la presión portal y podría utilizarse en combinación al tratamiento endoscópico.
!! RECUERDA. La recidiva hemorrágica tras el control inicial de la he- morragia es muy frecuente. Por este motivo, resulta preceptivo iniciar un tratamiento específico para su prevención. Éste se basa en el uso de betabloqueantes no cardioselectivos más ligadura de las varices hasta su erradicación.
Como se ha mencionado previamente, la DPPI se reserva para aquellos pacien- tes que vuelven a presentar una he- morragia por varices a pesar de recibir tratamiento adecuado combinado con fármacos y ligadura endoscópica.
Varices gástricas
La prevalencia de varices gástricas (VG) en pacientes con cirrosis se estima en aproximadamente un 17%. De acuerdo a su ubicación dentro del estómago, las VG se clasifican como varices esofago- gástricas (GOV) y varices gástricas aisla- das (IGV) (veáse Tabla 3.4).
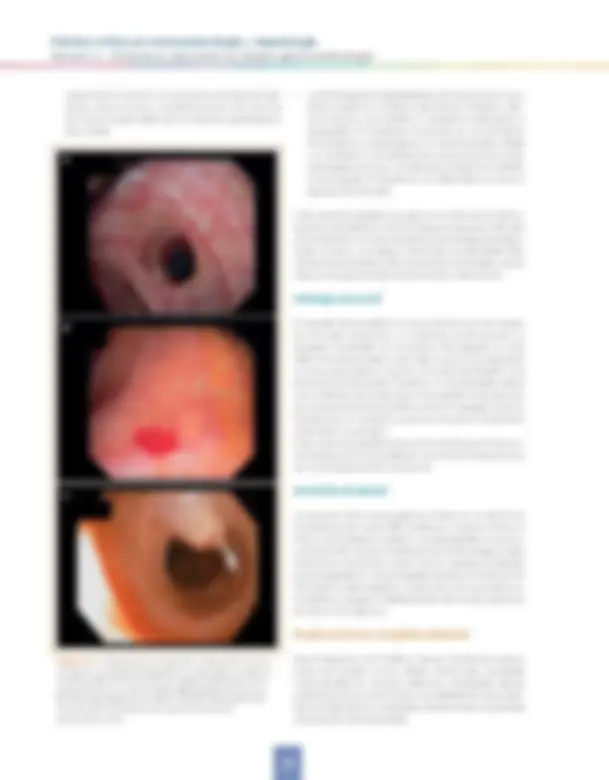
Las GOV se dividen en GOV1, que son varices esofágicas que se extienden por
debajo de la unión gastroesofágica a lo largo de la curvatura me- nor del estómago, y GOV2, que son las que se extienden más allá de la unión gastroesofágica en el fundus del estómago (Figura 3.6). Las IGV incluyen IGV1, que son las ubicadas en el fundus del estómago y que son también denominadas varices fúndicas, e IGV2, que se refieren a las varices ectópicas situadas en cual- quier parte del estómago. Esta clasificación tiene importantes implicaciones clínicas en relación con la incidencia, riesgo de sangrado y de tratamiento. Las GOV1 representan casi el 75%; las GOV2, el 21%, IGV1, menos de 2% y las IGV2, el 4% de todas las VG. Las GOV1 son una continuación de las varices esofágicas y comparten con ellas la misma anatomía vascular y la misma respuesta al tratamiento ya descrito. El tratamiento es diferen- te para las IGV1 y GOV2. No obstante, aunque los estudios más recientes detallan específicamente los diferentes tipos de GV, la mayoría de los datos disponibles provienen de series retrospec- tivas y heterogéneas de pacientes con diferentes etiologías de hipertensión portal (cirrótica y no cirrótica) y diferentes tipos de GV. Por todo ello, el tratamiento óptimo de las varices gástricas no está bien definido.
El riesgo de hemorragia de estas varices es poco conoci- do pero probablemente se situaría alrededor de un 10-15% anual. Los factores descritos que se han relacionado con un mayor riesgo de hemorragia son los mismos que en las vari- ces esofágicas (tamaño, presencia de signos rojos y grado de insuficiencia hepática). No existen datos suficientes para re- comendar cuál es la mejor estrategia profiláctica en estos pa- cientes. Nuestra práctica habitual es utilizar betabloqueantes y abstención terapéutica en caso de no tolerancia a los mismos. En espera de más datos consideramos que el riesgo inherente
Figura 3.6. Localización anatómica de varices gástricas
al uso de adhesivos, como el cianoacrilato, no está justificado en esta indicación.
!! RECUERDA. En las varices gástricas localizadas en el fundus del estómago, el tratamiento endoscópico a utilizar es la inyección de adhesivos tisulares.
Figura 3.7. El tratamiento inicial de la HDA por varices gástricas es similar al de la HDA por varices esofágicas. En el caso de las varices gástricas, el tratamiento endoscópico de elección es la inyección de sustancias adhesivas